Trắc nghiệm: Kim loại tác dụng với nước
Chuyên đề Hóa học lớp 9: Trắc nghiệm: Kim loại tác dụng với nước được VnDoc sưu tầm và giới thiệu tới các bạn học sinh cùng quý thầy cô tham khảo. Nội dung tài liệu sẽ giúp các bạn học sinh học tốt môn Hóa học lớp 9 hiệu quả hơn. Mời các bạn tham khảo.
Bài tập: Kim loại tác dụng với nước
Bài 1: Cho 1,24 g hỗn hợp Na và K tác dụng hết với nước, sau phản ứng thu được 1,92 gam hỗn hợp 2 bazơ NaOH và KOH. Thể tích khí H2 sinh ra ở đktc là:
A. 0,224 lít B. 0,48 lít C. 0,336 lít D. 0,448 lít
Bài 2: Cho hỗn hợp X gồm 2 kim loại kiềm tan hết trong nước tạo ra dung dịch Y và thoát ra 0,12 mol H2. Thể tích dung dịch H2SO4 2M cần trung hòa dung dịch Y là:
A. 120ml B. 60ml C. 150ml D. 200ml
Bài 3: Cho 8,5g hỗn hợp Na và K tác dụng với nước thu được 3,36l khí hidro (đktc) và dung dịch X. Cho X tác dụng vừa đủ với dung dịch Fe2(SO4)3 thu được m(g) kết tủa. Giá trị của m là:
A. 5,35g B. 16,05g C. 10,70g D. 21,40g
Bài 4: Cho 0,6 gam hỗn hợp gồm hai kim loại ở 2 chu kỳ liên tiếp thuộc nhóm IA tác dụng hết với H2O (dư), thoát ra 0,672 lít khí H2 (ở đktc). Hai kim loại đó là: (cho Li = 7, Na= 23, K = 39; Ca = 40)
A. Li và Na. B. Li và K C. Na và K. D. Ca và K
Bài 5: Cho 1,77 g hỗn hợp Ca và Ba tác dụng hết với nước, sau phản ứng thu được 2,45g hỗn hợp 2 bazơ Ca(OH)2 và Ba(OH)2. Thể tích khí H2 sinh ra ở đktc là:
A. 0,224 lít B. 0,448 lít C. 0,336 lít D. 0,48 lít
Bài 6: Cho 0,85 g hỗn hợp 2 kim loại Na và K tác dụng hết với nước, sau phản ứng thu được 0,336 lít khí H2 (đktc). Tổng khối lượng hiđroxit sinh ra là:
A. 0,48g B. 1,06g C. 3,02g D. 2,54g
Bài 7: Cho một hỗn hợp kim loại Na-Ba tác dụng với nước dư, thu được dung dịch X và 3,36l H2 (đktc). Thể tích dung dịch axit HCl 2M cần dùng để trung hòa dung dịch X là:
A. 150ml B. 75ml C. 60ml D. 30ml
Bài 8: Cho hỗn hợp Na, K, Ba tác dụng hết với nước, thu được dung dịch X và 6,72l khí H2 (đktc). Nếu cho X tác dụng hết với dung dịch Al(NO3)3 thì khối lượng kết tủa lớn nhất thu được là:
A. 7,8g B. 15,6g C. 46,8g D. 3,9g
Bài 9: Chọn câu phát biểu đúng:
A. Mg không phản ứng với nước ở điều kiện thường.
B. Mg phản ứng với N2 khi được đun nóng.
C. Mg cháy trong khí CO2 ở nhiệt độ cao.
D. Các câu trên đều đúng.
Bài 10: Cho Bari vào nước được dung dịch A. Cho lượng dư dung dịch Na2CO3 và dung dịch A rồi dẫn tiếp luồng khí CO2 vào đến dư. Hiện tượng nào đúng trong số các hiện tượng sau
A. Sủi bọt khí, xuất hiện kết tủa trắng rồi tan
B. Bari tan, xuất hiện kết tủa trắng, rối tan
C. Bari tan, sủi bọt khí hidro, đồng thời xuất hiện kết tủa trắng
D. Bari tan, sủi bọt khí hidro, xuất hiện kết tủa trắng, rồi tan
Đáp án và hướng dẫn giải
| 1. D | 2. B | 3. C | 4. A | 5. B |
| 6. A | 7. B | 8. B | 9. D | 10. D |
Bài 1:
2Na + 2H2O → 2NaOH + H2
x…………………x……x/2…….mol
2K + 2H2O → 2KOH + H2
y…………………y……..y/2………..mol
Theo bài ra, ta có hệ phương trình:
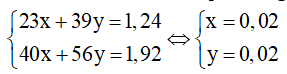
⇒ nH2 = x/2 + y/2 = 0,1+ 0,1 = 0,02 mol
⇒ VH2 = 0,02.22,4=0,448 mol
⇒ Chọn D.
Bài 2:
Quy đổi 2 kim loại kiềm là 1 kim loại trung bình M. Khi đó:
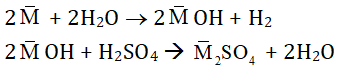
Ta thấy:
nMOH = 2nH2 = 2.0,12 = 0,24 mol
⇒ nH2SO4 = 1/2 nMOH = 1/2 . 0,24 = 0,12 mol
⇒ VH2SO4 = 0,12/2 = 0,06 lit = 60ml
⇒ Chọn B.
Bài 3:
Quy đổi 2 kim loại kiềm Na và K là 1 kim loại trung bình . Khi đó:
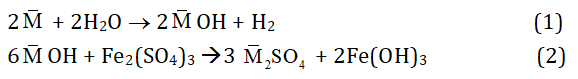
Theo bài ta có:
nH2 = 3,36/22,4 = 0,15 mol
⇒ nMOH = 2nH2 = 2.0,15 = 0,3 mol
⇒ nFe(OH)3 = 1/3 nMOH = 1/3.0,3 = 0,1 mol
⇒ m↓ = mFe(OH)3 = 0,1.107 = 10,7 g
⇒ Chọn C.
Bài 4: Tương tự bài 2(Bài tập mẫu)
⇒ Chọn A.
Bài 5:
Ca + 2H2O → Ca(OH)2 + H2
x………………...x……………x……….mol
Ba + 2H2O → Ba(OH)2 + H2
y………………y…………..y…………mol
Giải hệ phương trình:
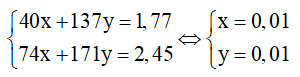
⇒ nH2 = x+y = 0,02 mol
⇒ VH2 = 0,02.22,4 = 0,448 lit
⇒ Chọn B.
Bài 6: Tương tự bài 1.
Chọn A.
Bài 7:
2Na + 2H2O → 2NaOH + H2
Ba + 2H2O → Ba(OH)2 + H2
Từ 2 phương trình trên ta có nhận xét:
nOH- = 2nH2 = 2.33,6/22,4 = 0,15 mol
Mà: OH- + H+ → H2O
⇒ nOH- = nH+ = 0,15 mol = nHCl
⇒ VHCl = 0,15/2 = 0,075 lit = 75ml
⇒ Chọn B.
Bài 8:
Từ nhận xét của bài 7 ta có:
nOH- = 2nH2 = 2.6,72/22,4 = 0,6 mol
Cho X tác dụng với Al(NO3)3, đạt kết tủa lớn nhất khi Al(OH)3 tạo ra chưa bị hòa tan bởi các hidroxit kiềm, kiềm thổ trong X, khi đó:
Al3+ + 3OH- → Al(OH)3
⇒ nAl(OH)3 = 1/3 nOH- = 1/3 . 0,6 = 0,2 mol
⇒ m↓ = mAl(OH)3 = 0,2.78 = 15,6g
⇒ Chọn B.
Bài 10:
Giải thích bằng PTHH:
Ba + 2H2O → Ba(OH)2 + H2
Na2CO3 + Ba(OH)2 → BaCO3 + 2NaOH
BaCO3 + CO2 + H2O → Ba(HCO3)2
Hiện tượng: Bari tan, sủi bọt khí, sau đó tạo kết tủa, cuối cùng kết tủa tan dần.
⇒ Chọn D.
Trên đây VnDoc đã giới thiệu tới các bạn lý thuyết Hóa học 9: Trắc nghiệm: Kim loại tác dụng với nước. Để có kết quả cao hơn trong học tập, VnDoc xin giới thiệu tới các bạn học sinh tài liệu Chuyên đề Hóa học 9, Giải bài tập Hóa học lớp 9, Giải bài tập Vật Lí 9, Tài liệu học tập lớp 9 mà VnDoc tổng hợp và giới thiệu tới các bạn đọc







