Trắc nghiệm: Kim loại tác dụng với muối
Chuyên đề Hóa học lớp 9: Trắc nghiệm: Kim loại tác dụng với muối được VnDoc sưu tầm và giới thiệu tới các bạn học sinh cùng quý thầy cô tham khảo. Nội dung tài liệu sẽ giúp các bạn học sinh học tốt môn Hóa học lớp 9 hiệu quả hơn. Mời các bạn tham khảo.
Bài tập: Kim loại tác dụng với muối
Bài 1: Ngâm một lá sắt trong dung dịch CuSO4. Nếu biết khối lượng đồng bám trên lá sắt là 9,6 gam thì khối lượng lá sắt sau ngâm tăng thêm bao nhiêu gam so với ban đầu?
A. 5,6 gam B. 2,8 gam C. 2,4 gam D. 1,2 gam
Bài 2: Nhúng một lá nhôm vào 200ml dung dịch CuSO4, đến khi dung dịch mất màu xanh, lấy lá nhôm ra cân thấy nặng hơn so với ban đầu là 1,38 gam. Nồng độ của dung dịch CuSO4 đã dùng là:
A. 0,05 M B. 0,15 M C.0,2 M D. 0,25 M
Bài 3: Nhúng một thanh nhôm nặng 25 gam vào 200 ml dung dịch CuSO4 0,5M. Sau một thời gian, cân lại thanh nhôm thấy cân nặng 25,69 gam. Nồng độ mol của CuSO4 và Al2SO4 trong dung dịch sau phản ứng lần lượt là
A. 0,425M và 0,2M B. 0,425M và 0,3M
C. 0,4M và 0,2M D. 0,425M và 0,025M.
Bài 4: Cho 0,01 mol Fe vào 50 ml dung dịch AgNO3 1M. Khi phản ứng xảy ra hoàn toàn thì khối lượng Ag thu được là:
A. 5,4 g B. 2,16 g C. 3,24 g D. Giá trị khác
Bài 5: Cho 4,62 gam hỗn hợp X gồm bột 3 kim loại (Zn, Fe, Ag) vào dung dịch chứa 0,15mol CuSO4. Sau khi phản ứng xảy ra hoàn toàn, thu được dung dịch Y và chất rắn Z. Dung dịch Y có chứa muối nào sau đây:
A. ZnSO4, FeSO4 B. ZnSO4
C. ZnSO4 , FeSO4, CuSO4 D. FeSO4
Bài 6: Ngâm một đinh sắt sạch trong 200ml dung dịch CuSO4. Sau khi phản ứng kết thúc, lấy đinh sắt ra khỏi dung dịch rửa sạch nhẹ bằng nước cất và sấy khô rồi đem cân thấy khối lượng đinh sắt tăng 0,8 gam so với ban đầu. Nồng độ mol của dung dịch CuSO4 đã dùng là giá trị nào dưới đây?
A. 0,05M B. 0,0625M C. 0,50M D. 0,625M.
Bài 7: Cho 8,3g hỗn hợp X gồm Fe và Al vào 1lít dung dịch CuSO4 0,2 M, sau khi phản ứng xảy ra hoàn toàn thu được 15,68g chất rắn Y gồm 2 kim loại. Thành phần phần trăm theo khối lượng của nhôm trong hỗn hợp X là:
A. 32,53% B. 53,32% C. 50% D. 35,3%
Bài 8: Hòa tan hết m gam hỗn hợp X gốm Mg, FeCl3 vào nước chỉ thu được dung dịch Y gồm 3 muối và không còn chất rắn. Nếu hòa tan m gam X bằng dung dịch HCl dư thì thu được 2,688 lít H2 (đktc). Dung dịch Y có thể hòa tan vừa hết 1,12 gam bột Fe. Giá trị của m là:
A. 46,82 gam B. 56,42 gam C. 48,38 gam D. 52,22 gam
Bài 9: Hòa tan 3,28 gam hỗn hợp muối MgCl2 và Cu(NO3)2 vào nước được dung dịch A . Nhúng vào dung dịch A một thanh sắt. Sau một khoảng thời gian lấy thanh sắt ra cân lại thấy tăng thêm 0,8 gam. Cô cạn dung dịch sau phản ứng thu được m gam muối khan. Giá trị m là:
A. 4,24 gam B. 2,48 gam C. 4,13 gam D. 1,49 gam.
Bài 10: Cho m gam Mg vào 100 ml dung dịch A chứa ZnCl2 và CuCl2, phản ứng hoàn toàn cho ra dung dịch B chứa 2 ion kim loại và một chất rắn D nặng 1,93 gam. Cho D tác dụng với dung dịch HCl dư còn lại một chất rắn E không tan nặng 1,28 gam. Tính m.
A. 0,24 gam B. 0,48 gam C. 0,12 gam D. 0,72 gam
Đáp án và hướng dẫn giải
| 1. D | 2. B | 3. D | 4. C | 5. C |
| 6. C | 7. A | 8. C | 9. B | 10. D |
Bài 1:
Fe + CuSO4 → FeSO4 + Cu
Theo bài ta có: nCu bam vao = 9,6/64 = 0,15 mol
Theo PTHH ta có:
⇒ mMg = 0,03.24 = 0,72g
⇒ mCu bám vào – mFe tan = mFe tăng
⇔ 9,6 - 0,15.56 = 1,2g
⇒ mFe tăng = 1,2 gam
⇒ Chọn D.
Bài 2:
2Al + 3CuSO4 → Al2(SO4)3 + 3Cu
2x………3x…………..x………………3x (Mol)
Theo bài ta có:
mCu bám vào – mAl tan = mAl tăng
⇔ 3x.64 -2x.27 = 1,38 ⇔ 138x = 1,38
⇔ x = 0,01 mol
⇒ nCuSO4 = 3x = 3.0,01 = 0,03 mol
⇒ CM(CuSO4) = 0,03/0,2 = 0,15 mol
⇒ Chọn B.
Bài 3:
nCuSO4 = 0,5.0,2 = 0,1 mol
2Al + 3CuSO4 → Al2(SO4)3 + 3Cu
2x………3x…………..x………………3x (Mol)
Theo bài ta có:
mCu bám vào – mAl tan = mAl tăng
⇔ 3x.64 - 2x.27 = 25,69 - 25
⇔ 138x = 0,69
⇔ x = 0,005 mol
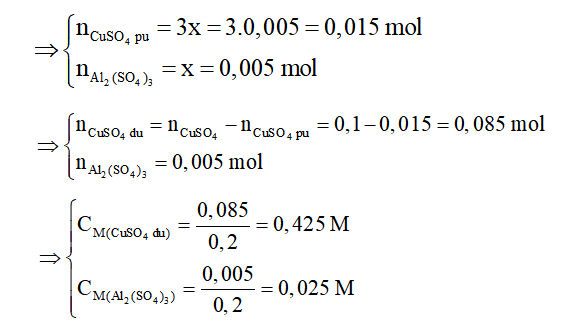
⇒ Chọn D.
Bài 4:
Fe + 2AgNO3 → Fe(NO3)2 + 2Ag
Ban đầu 0,01...1.0,05……………………………………mol
Phản ứng 0,01…0,02…………..0,01………0,02……mol
Sau pứ 0..………0,03…………0,01………0,02……mol
AgNO3 + Fe(NO3)2 → Fe(NO3)3 + Ag
Ban đầu 0,03………..0,01…………………………………..mol
Phản ứng 0,01………...0,01………………………0,01…mol
Sau pứ 0,02…………..0…………………………0,01….mol
⇒ mAg = (0,01+0,02).108 = 3,24g
⇒ Chọn C.
Bài 5: Ta thấy Ag không tác dụng với CuSO4 ⇒ Dd sau phản ứng có thể có các muối ZnSO4, FeSO4, CuSO4
⇒ Chọn C.
Bài 6: Tương tự bài 1(Bài tập mẫu)
⇒ Chọn C.
Bài 7:
2Al + 3CuSO4 → Al2(SO4)3 + 3Cu
x…………3/2.x
Fe + CuSO4 → FeSO4 + Cu
y……..y
Al phản ứng hết với CuSO4 sau đó Fe mới phản ứng với CuSO4. Vì sau phản ứng thu được rắn Y gồm 2 kim loại nên Al đã tan hết và Fe có thể đã phản ứng 1 phần hoặc chưa phản ứng. 2 kim loại trong Y là Fe và Cu.
⇒ nCu = nCuSO4 = 0,2.1 = 0,2 mol
⇒ mFe dư = mY - mCu = 15,68 - 0,2.64 = 2,88g
Đặt số mol Al ban đầu là x, số mol Fe phản ứng là y, ta có hệ phương trình:
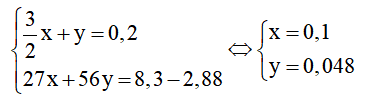
⇒ mAl = 0,1.27 = 2,7g
⇒ %mAl = 2,7/8,3.100 = 32,53%
⇒ Chọn A.
Bài 8:
Mg + 2FeCl3 → MgCl2 + 2FeCl2 (1)
Mg + HCl → MgCl2 + H2 (2)
Từ phản ứng (2) ta có:
nMg = nH2 = 2,688/22,4 = 0,12 mol
Dung dịch Y gồm 3 muối ⇒ MgCl2, FeCl2, FeCl3 ⇒ FeCl3 sau phản ứng (1) còn dư.
⇒ nFeCl3(1) = 2.nMg = 2.0,12 = 0,24g
Fe + 2FeCl3 → 3FeCl2 (3)
⇒ nFeCl3(3) = 2nFe = 0,04 mol
⇒ nFeCl3 bđ = nFeCl3(3) + nFeCl3(1) = 0,04+0,24 = 0,28g
⇒ mX = 0,12.24 + 0,28.(56+35,5.3) = 48,3g
⇒ Chọn C.
Bài 9:
Fe + Cu(NO3)2 → Fe(NO3)2 + Cu
x……….x………………..x……………x……mol
Theo phương trình ta có nhận xét là thanh sắt tăng lên 0,8 gam thì dung dịch sẽ giảm khối lượng đi 0,8 gam (theo định luật bảo toàn khối lượng)
⇒ mdd = mdd bđ - 0,8 =3,28 - 0,8 = 2,48 g
⇒ Chọn B.
Bài 10:
Mg + CuCl2 → MgCl2 + Cu
Mg + ZnCl2 → MgCl2 + Zn
Theo bài ta suy ra: Mg tan hết, CuCl2 phản ứng hết, ZnCl2 còn dư.
⇒ mCu = mE khong tan = 1,28g ⇒ nCu = 1,28/64 = 0,02 mol
⇒ mZn = mD - mCu = 1,93 - 1,28 = 0,65g ⇒ nZn = 0,65/65 = 0,01 mol
⇒ nMg = nZn + nCu = 0,03 mol ⇒ mMg = 0,03.24=0,72g
⇒ Chọn D.
Trên đây VnDoc đã giới thiệu tới các bạn lý thuyết Hóa học 9: Trắc nghiệm: Kim loại tác dụng với muối. Để có kết quả cao hơn trong học tập, VnDoc xin giới thiệu tới các bạn học sinh tài liệu Chuyên đề Hóa học 9, Giải bài tập Hóa học lớp 9, Giải bài tập Vật Lí 9, Tài liệu học tập lớp 9 mà VnDoc tổng hợp và giới thiệu tới các bạn đọc.







