Hỗn hợp kim loại tác dụng với axit
Chuyên đề Hóa học lớp 9: Hỗn hợp kim loại tác dụng với axit được VnDoc sưu tầm và giới thiệu tới các bạn học sinh cùng quý thầy cô tham khảo. Nội dung tài liệu sẽ giúp các bạn học sinh học tốt môn Hóa học lớp 9 hiệu quả hơn. Mời các bạn tham khảo.
Lý thuyết: Hỗn hợp kim loại tác dụng với axit
I/ Lý thuyết và phương pháp giải
Dãy hoạt động kim loại
K, Na, Mg, Al, Zn, Fe, Pb, (H), Cu, Ag, Au
Khi Nào May Áo Záp Sắt Phải Hỏi Cúc Bạc Vàng
Dãy được sắp xếp theo chiều giảm dần tính hoạt động hoá học (từ trái sang phải).
- Một số kim loại vừa tác dụng được với axit và với nước: K, Na, Ba, Ca.
Kim loại + H2O → Dung dịch bazơ + H2
- Kim loại vừa tác dụng với axit, vừa tác dụng với bazơ: (Be), Al, Zn, Cr
2A + 2(4 – n)NaOH + 2(n – 2)H2O → 2Na4 –nAO2 + nH2
Ví dụ: 2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2
- Kim loại đứng trước H tác dụng với dung dịch axit HCl, H2SO4 loãng tạo muối và giải phóng H2.
Kim loại + Axit → Muối + H2
Lưu ý:
- Kim loại trong muối có hoá trị thấp (đối với kim loại đa hoá trị).
- Trừ Au và Pt, các kim loại khác đều có thể tác dụng với HNO3 và H2SO4 đặc, nóng nhưng không giải phóng Hidro.
Phương pháp giải:
- B1: Viết PTHH.
- B2: Xử lí số liệu theo dữ kiện đề bài, đặt ẩn số, lập hệ (nếu cần).
- B3: Tính số mol chất cần tìm theo PTHH và hệ PT.
- B4: Tính toán theo yêu cầu của bài toán.
II/Bài tập vận dụng
Bài 1: Cho 3,79g hỗn hợp hai kim loại là Zn và Al tác dụng với dung dịch H2SO4 loãng dư, thu được 1792 ml khí (đktc). Tính khối lượng từng kim loại trong hỗn hợp.
Hướng dẫn:
Zn + H2SO4 → ZnSO4 + H2 (1)
2Al + 3H2SO4 → Al2(SO4)3 + 3H2 (2)
Số mol khí H2 thu được:
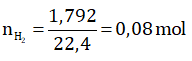
Gọi a và b lần lượt là số mol Zn và Al trong hỗn hợp.
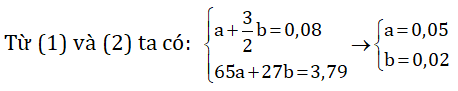
Khối lượng Zn: 65.0,05 = 3,25 g
Khối lượng Al: 27.0,02 = 0,54 gam
Bài 2: Hỗn hợp 3 kim loại Fe, Al, Cu nặng 17,4 gam. Nếu hòa tan hỗn hợp bằng axit H2SO4 loãng dư thì thoát ra 8,96 dm3 H2 (ở đktc). Còn nếu hòa tan hỗn hợp bằng axit đặc nóng, dư thì thoát ra 12,32 lít SO2 (ở đktc). Tính khối lượng mỗi kim loại ban đầu.
Hướng dẫn:
- Cu không tan trong H2SO4 loãng, chỉ có Fe và Al tan được trong axit loãng
Fe + H2SO4 → FeSO4 + H2↑
2Al + 3H2SO4 → Al2(SO4)3 + 3H2↑
- H2SO4 đặc nóng hòa tan cả 3 kim loại:
2Fe + 6H2SO4 → Fe2(SO4)3 + 3SO2↑ + 6H2O
2Al + 6H2SO4 → Al2(SO4)3 + 3SO2↑ + 6H2O
Cu + 2H2SO4 → CuSO4 + SO2↑ + 2H2O
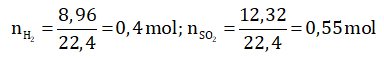
- Gọi số mol của Fe, Al, Cu lần lượt là x, y, z ta có hệ phương trình :
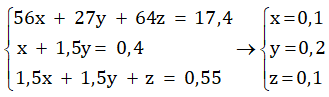
Khối lượng của sắt ban đầu là : mFe = 0,1. 56 = 5,6 (gam)
Khối lượng của nhôm ban đầu là : mAl = 0,2. 27 = 5,4 (gam)
Khối lượng của đồng ban đầu là : mCu = 0,1. 64 = 6,4 (gam)
Bài 3: Cho H2SO4 loãng, dư tác dụng với hỗn hợp gồm Mg và Fe thu được 2,016 lít khí ở đktc. Nếu hỗn hợp kim loại này tác dụng với dd FeSO4 dư thì khối lượng hỗn hợp trên tăng lên 1,68 gam.
a) Viết phương trình phản ứng hóa học.
b) Tìm khối lượng mỗi kim loại trong hỗn hợp trên.
Hướng dẫn:
a) Ta có PTHH:
Mg + H2SO4 → MgSO4 + H2↑ (1)
x mol x mol x mol
Fe + H2SO4 → FeSO4 + H2↑ (2)
y mol y mol y mol
Cho hỗn hợp kim loại trên vào dd FeSO4 dư thì Mg tác dụng hết (Fe không tác dụng) theo phương trình sau:
Mg + FeSO4 → MgSO4 + Fe (3)
x mol x mol
→ khối lượng hỗn hợp tăng lên 1,68 gam là khối lượng chênh lệch giữa Fe mới tạo ra và Mg đã phản ứng. (sự tăng giảm khối lượng)
b) Ta có số mol của khí H2 là:
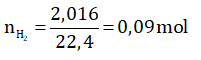
Theo phương trình (1) và (2) ta có hệ phương trình :
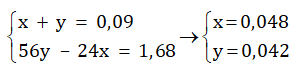
Vậy khối lượng của 2 kim loại trên là:
→ mFe = 0,048. 56 = 2,688 (gam)
→ mMg = 0,042. 24 = 1,008 (gam)
Với chuyên đề: Hỗn hợp kim loại tác dụng với axit trên đây chúng ta có thể hiểu rõ các khái niệm về dãy hoạt động kim loại, các phản ứng hóa học thường xảy ra.







