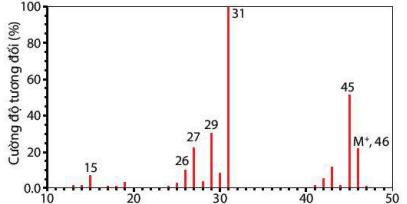
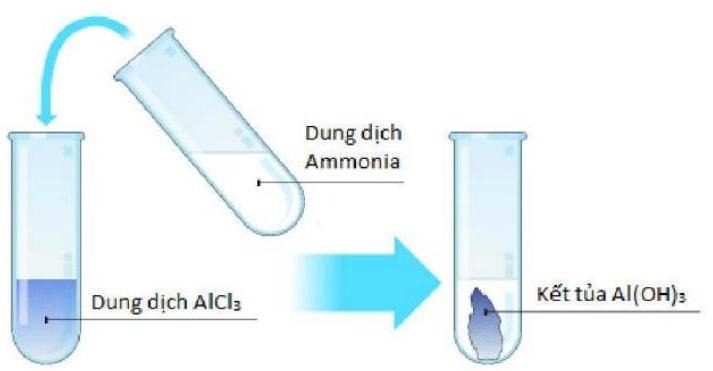
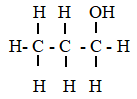Cân bằng chuyển dịch khi nén piston
Xét cân bằng sau diễn ra trong một piston ở một nhiệt độ không đổi:
N2(g) + 3H2(g) ⇌ 2NH3(g)
Nếu nén piston thì cân bằng chuyển dịch theo chiều nào?
Khi nén piston (tăng áp suất) cân bằng sẽ chuyển dịch theo chiều làm giảm áp suất, tức chiều làm giảm số mol khí hay chiều thuận.