Phenol
1. Khái niệm phenol
Phenol là những hợp chất hữu cơ trong phân tử có nhóm –OH liên kết trực tiếp với nguyên tử carbon của vòng benzene.
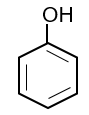
Phenol cũng là tên của chất đơn giản nhất (monohydroxybenzene) trong nhóm các hợp chất phenol.
 |
 |
 |
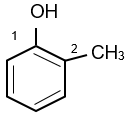
| phenol | 2-methylphenol | hydroquinone |
2. Đặc điểm cấu tạo và hình dạng phân tử phenol
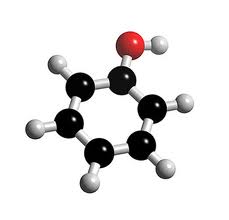
Phenol đơn giản nhất có công thức phân tử C6H6O và công thức cấu tạo C6H5OH hoặc:
 |
 |
| Mô hình quả cầu -thanh nối của phân tử phenol | Mô hình đặc của phân tử phenol |
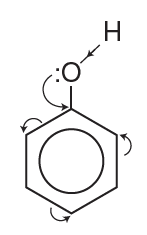
Phenol có nhóm phenyl hút electron, làm giảm mật độ electron ở nguyên tử oxygen, dẫn đến tăng sự phân cực của liên kết O-H đồng thời làm tăng mật độ electron trong vòng benzene, đặc biệt ở vị trí o,p.
II. Tính chất vật lý
Phenol là chất rắn, không màu, ít tan trong nước lạnh, tan vô hạn trong nước ở 66℃, tan tốt trong ethanol.
Phenol độc, gây bỏng cho da.
Các phenol có nhiệt độ nóng chảy, nhiệt độ sôi cao hơn các hydrocarbon thơm có khối lượng phân tử tương đương.
III. Tính chất hóa học
1. Phản ứng thế nguyên tử H của nhóm OH: tính acid
Trong dung dịch, phenol phân li không hoàn toàn tạo ra ion H+:
C6H5OH ![]() \(\rightleftharpoons\) C6H5O- + H+
\(\rightleftharpoons\) C6H5O- + H+
Phenol thể hiện tính acid yếu, dung dịch phenol không làm đổi màu quỳ tím.
Do nhóm phenyl hút electron, làm tăng sự phân cực của liên kết O-H, dẫn đến tính acid của phenol.
Ví dụ:
C6H5OH + NaOH → C6H5ONa + H2O
sodium phenolate
2. Phản ứng thế nguyên tử hydrogen của vòng benzene
Nhóm OH làm tăng khả năng phản ứng thế nguyên tử H trong vòng benzene của phenol, ưu tiên thế nguyên tử H ở các vị trí 2, 4, 6.

|
2,4,6 – tribromophenol (kết tủa màu trắng) |
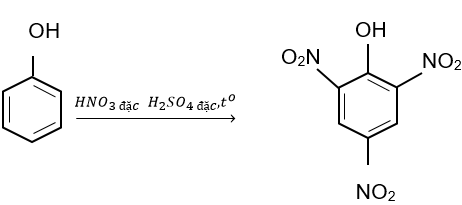 2,4,6 – trinitrophenol
2,4,6 – trinitrophenol
(kết tủa màu vàng)
IV. Ứng dụng và điều chế
1. Ứng dụng
Dung dịch phenol ở nồng độ thấp được sử dụng như chất sát trùng, diệt nấm, vi khuẩn, virus, thuốc tăng trưởng thực vật.

Trong công nghiệp, phenol là nguyên liệu ban đầu để sản xuất chất dẻo, chất kết dính (phenol formaldehyde), chất nổ (picric acid), tổng hợp dược phẩm (aspirin), hay sản xuất thuốc nhuộm azo.
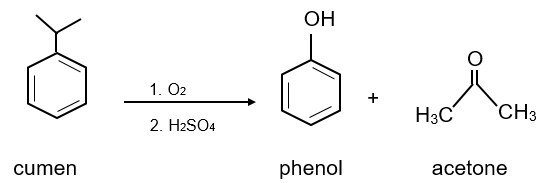
2. Điều chế
Trong công nghiệp phenol dược điều chế bằng cách: oxi hóa cumene (isoproylbenzene) nhờ oxygen trong không khí, sau đó thủy phân bằng dung dịch H2SO4 loãng
Ngoài ra, một lượng lớn phenol được tách ra từ nhựa than đá.






