Carboxylic acid
1. Khái niệm cấu trúc của Carboxylic Acid
Nhóm chức carboxyl (-COOH) gồm nhóm hydroxy (–OH) liên kết với nhóm carbonyl (>C=O)
Các hợp chất chứa nhóm carboxyl gọi là carboxylic acid.
Carboxylic acid trong phân tử có 1 nhóm -COOH gọi là monocarboxylic acid hay còn gọi là acid hữu cơ đơn chức.
Ví dụ: CH3COOH: methanoic acid
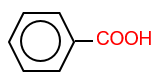 : benzoic acid
: benzoic acid
Carboxylic acid chứa từ 2 nhóm chức COOH trở lên gọi là acid hữu cơ đa chức:
Ví dụ:
HOOC-CH2-COOH: malonic acid
Dãy đồng đẳng carboxylic acid đơn chức, no, mạch hở có công thức chung CnH2n+1COOH (n≥0)
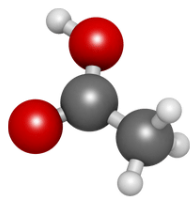
2. Đặc điểm cấu tạo, hình dạng phân tử và tính chất của acetics acid
 |
 |
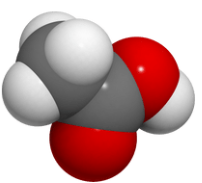 |
Cấu tạo và mô hình phân tử của acetic acid
Acetic acid nguyên chất là chất lỏng, mùi xúc gây bỏng da.
Acetic acid nguyên chất đông 16oC tạo thành tỉnh thể giống nước đã được gọi là “Acetic acid băng"
3. Viết công thức cấu tạo và gọi tên một số Carboxylic Acid
Tên theo danh pháp thay thế của Carboxylic Acid đơn chức, mạch hở:

Mạch chính là mạch carbon dài nhất chứa nhóm -COOH.
Đánh số nguyên tử carbon của nhóm -COOH là 1.
Ví dụ:
CH3–CH2–COOH: Propanoic acid
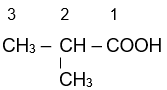
2-methylpropanoic
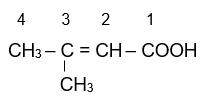
3-methylbut-enoic acid.
II. Tính chất vật lý
Hầu như là chất lỏng hoặc chất rắn ở điều kiện thường.
Do cấu tạo của nhóm carboxyl nên carboxylic acid có khả năng tạo thành liên kết hydrogen bền vững hơn liên kết hydrogen giữa các phân tử alcohol, do đoảnh hưởng lớn đến tính chất vật lí của chúng.
Nhiệt độ sôi của carboxylic acid cao hơn nhiệt độ sôi của alcohol, aldehyde, ketone tương ứng vì có liên kết hydrogen giữa 2 phân tử hoặc giữa nhiều phân tử.
Nhờ khả năng tạo liên kết hydrogen với nước, các carboxylic acid đầu dãy tan vô hạn trong nước, độ tan giảm dần theo độ tăng chiều dài mạch carbon.
III. Tính chất hóa học
Nhóm >C=O hút electron nên liên kết O-H trong carboxylic acid phân cực hơn so với alcohol, phenol.
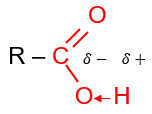
Trong dung dịch nước, carboxylic acid phân li theo cân bằng:
RCOOH ![]() \(\rightleftharpoons\) RCOO- + H+
\(\rightleftharpoons\) RCOO- + H+
1. Tính acid.
- Làm đổi màu giấy quỳ tím thành màu đỏ;
- Phản ứng được với các kim loại đứng trước hydrogen trong dãy hoạt động hoá học, giải phóng khí hydrogen.
- Tác dụng được với oxide base, base.
- Tác dụng được với một số muối…
Ví dụ:
2(CH3)2CHCOOH + Ca → [(CH3)2CHCOO]2Ca + H2↑
HOOC – COOH + 2NaOH → NaOOC – COONa + 2H2O
2HCOOH + Na2CO3 → 2HCOONa + CO2↑ + H2O
2C2H5COOH + CuO → (C2H5COO)2Cu + H2O.
2. Phản ứng ester hóa: phản ứng với alcohol tạo ester
Ví dụ:
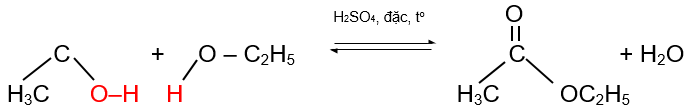
CH3COOH + C2H5OH ![]() \(\overset{H_{2}SO_{4} \: đặc, \: t^{o} }{\underset{}{\rightleftharpoons}}\) CH3COOC2H5 + H2O.
\(\overset{H_{2}SO_{4} \: đặc, \: t^{o} }{\underset{}{\rightleftharpoons}}\) CH3COOC2H5 + H2O.
IV. Ứng dụng của một số carboxylic acid thông dụng
Carboxylic acid có nhiều ứng dụng trong các lĩnh vực như: thực phẩm, dược phẩm, mỹ phẩm, y tế, phẩm nhuộm, tổng hợp hữu cơ,…
Formic acid được dùng làm chất cầm màu trong công nghiệp nhuộm, da, cao su, mạ điện, sáp và dung môi.
Acetic acid được dùng để sản xuất các hợp chất vinyl acetate, acetic anhydride và acetate ester.
Benzoic acid được dùng trong tổng hợp phẩm nhuộm, trong y học và công nghiệp dược phẩm.
V. Điều chế
1. Phương pháp lên men giấm
sử dụng men giấm để oxi hóa ethanol bằng oxygen không khí thành acetic acid.
CH3CH2OH + O2 ![]() \(\xrightarrow[]{men \: giấm, \: 20^{o} C-30^{o} C}\) CH3COOH + H2O
\(\xrightarrow[]{men \: giấm, \: 20^{o} C-30^{o} C}\) CH3COOH + H2O
2. Phương pháp oxi hóa alkane
Oxi hóa không hoàn toàn các alkane tạo thành các carboxylic acid
2R-CH2-CH2-R' + 5O2 ![]() \(\xrightarrow[]{xt,\: t^{o} }\) 2RCOOH + 2R'COOH + 2H2O
\(\xrightarrow[]{xt,\: t^{o} }\) 2RCOOH + 2R'COOH + 2H2O
Ví dụ: Acetic acid được sản xuất từ butane (C4H10) có xúc tác ở nhiệt độ cao
2C4H10 + 5O2 ![]() \(\xrightarrow[]{xt,\: 180^{o}C, \: 50\: bar }\) 4CH3COOH + 2H2O
\(\xrightarrow[]{xt,\: 180^{o}C, \: 50\: bar }\) 4CH3COOH + 2H2O






