Xác định chất là base theo thuyết Brønsted - Lowry
Theo thuyết Brønsted - Lowry chất nào sau đây là base?
Theo thuyết Brønsted - Lowry, base là chất nhận proton H+.
⇒ KOH là base.
Vndoc.com xin gửi tới bạn đọc Đề thi khảo sát chất lượng Hóa 11 tháng 1, cùng nhau luyện tập và xem kết quả nha!
Xác định chất là base theo thuyết Brønsted - Lowry
Theo thuyết Brønsted - Lowry chất nào sau đây là base?
Theo thuyết Brønsted - Lowry, base là chất nhận proton H+.
⇒ KOH là base.
pH của dung dịch KOH 0,01 M
Dung dịch KOH 0,01 M có pH bằng
[OH–] = 0,01 M ⇒ [H+] = = 10–12 M
⇒ pH = –log[H+] = –log10–12 = 12
Chất phản ứng với sulfur ngay ở nhiệt độ thường
Sulfur phản ứng với chất nào sau đây ngay ở nhiệt độ thường?
Sulfur phản ứng với Hg ngay ở nhiệt độ thường:
S + Hg → HgS
Tìm nhận xét đúng về tính chất của muối amonium
Trong các nhận xét dưới đây về muối ammonium, nhận xét nào đúng?
- Phân tử muối ammonium gồm cation ammonium và anion anion gốc acid.
- Dung dịch muối ammonium phản ứng với dung dịch base đặc, nóng thoát ra chất khí ammonia làm quỳ tím ẩm hoá xanh.
- Có một số muối ammonium khi nhiệt phân không tạo NH3. Ví dụ:
NH4NO3(s) N2O(g) + 2H2O(g)
Xác định biểu thức hằng số cân bằng KC
Cho phản ứng sau: 2C(s) + O2(g) 2CO(g). Biểu thức hằng số cân bằng KC của phản ứng là
Biểu thức hằng số cân bằng KC của phản ứng là:
Dung dịch sodium chloride dẫn được điện
Dung dịch sodium chloride (NaCl) dẫn được điện là do
Dung dịch sodium chloride (NaCl) dẫn được điện là do NaCl điện li trong nước thành ion Na+ và Cl-.
Xác định phản ứng sulfur dioxide là chất khử
Sulfur dioxide là chất khử trong phản ứng nào sau đây?
Trong phản ứng SO2 + NO2 → SO3 + NO, nguyên tử S trong SO2 nhường elcetron ⇒ SO2 đóng vai trò chất khử.
Chất chiếm phần trăm thể tích lớn nhất trong không khí
Trong không khí, chất nào sau đây chiếm phần trăm thể tích lớn nhất?
Trong không khí, nitrogen chiếm phần trăm thể tích lớn nhất (khoảng 78%).
Xác định dung dịch chuẩn được chọn
Để xác định nồng độ của dung dịch HCl, người ta dùng phương pháp chuẩn độ. Dung dịch chuẩn được chọn là
Nguyên tắc: Chuẩn độ acid – base là phương pháp được sử dụng để xác định nồng độ dung dịch acid hoặc dung dịch base bằng dung dịch base hoặc dung dịch acid đã biết chính xác nồng độ.
Tìm phát biểu không đúng về sulfur
Phát biểu nào sau đây không đúng?
Sulfur không tan trong nước, tan nhiều trong các dung môi hữu cơ như benzene, carbon disulfide,...
Aluminium không bị hòa tan trong dung dịch
Aluminium không bị hòa tan trong dung dịch
Một số kim loại như Al, Fe và Cr bị thụ động hóa trong dung dịch HNO3 đặc, nguội, do tạo ra màng oxide bền, bảo vệ kim loại khỏi tác dụng của acid.
Liên kết hoá học trong hợp chất hữu cơ
Liên kết hoá học trong hợp chất hữu cơ thường là
Liên kết hoá học trong hợp chất hữu cơ thường là liên kết cộng hoá trị.
Tìm kết luận đúng
Acetic acid có công thức cấu tạo là CH3COOH. Kết luận nào dưới đây là đúng?
- Acetic acid có công thức cấu tạo là CH3COOH ⇒ Công thức phân tử là C2H4O2 ⇒ CTĐGN là CH2O.
- Phân tử khối của acetic acid là 60.
Tách riêng các chất trong hỗn hợp X
Hỗn hợp X gồm các alkane: pentane (ts = 36,1 °C) và octane (ts = 125,7 °C). Có thể tách riêng các chất đó một cách thuận lợi bằng phương pháp nào sau đây?
Hỗn hợp X chứa các chất có nhiệt độ sôi khác nhau ⇒ có thể tách riêng bằng phương pháp chưng cất.
Nhóm chức có trong phân tử chất X
Chất X có công thức phân tử là C6H12O6 và có phổ hồng ngoại như hình dưới đây:
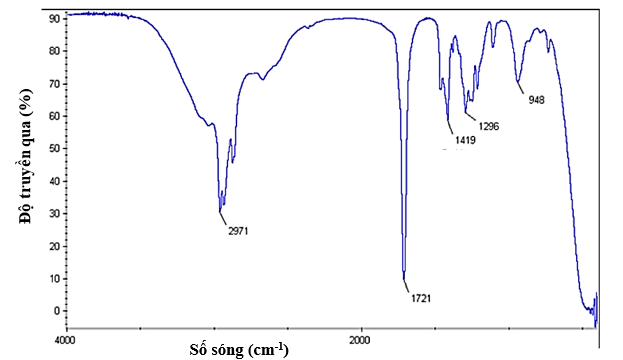
Nhóm chức có trong phân tử chất X là
Trên phổ IR của phân tử C6H12O2 ở hình có tín hiệu đặc trưng của nhóm COOH.
- Tín hiệu ở 2971 cm–1 là tín hiệu đặc trưng của liên kết O–H trong nhóm –COOH.
- Tín hiệu ở 1721 cm–1 là tín hiệu đặc trưng của liên kết C=O trong nhóm –COOH.
Chất X có công thức phân tử là C6H12O2 có chứa nhóm chức COOH của carboxylic acid.
Xác định pH của dung dịch X
X là dung dịch hỗn hợp HCl 0,005 M và H2SO4 0,0025 M. Vậy pH của dung dịch X là:
[H+] = [HCl] + 2[H2SO4] = 0,005 + 0,0025.2 = 0,01 M
⇒ pH = –log[H+] = –log0,01 = 2
Xác định phần trăm khối lượng của nguyên tố carbon
Phần phần trăm khối lượng của nguyên tố carbon trong C3H8O là
Phần phần trăm khối lượng của nguyên tố carbon trong C3H8O là:
Xác định phát biểu sai
Trong các phát biểu sau, phát biểu sai là
Mưa acid là hiện tượng nước mưa có pH < 5,6.
Tính số chất thuộc loại hydrocarbon
Cho các hợp chất sau: CH3COONa; C10H22; C2H5Cl; C2H2; CCl4; C2H4; NaCN. Số hợp chất thuộc loại hydrocarbon là
Công thức phân tử phù hợp của X
Phổ khối lượng của chất X cho biết X có phân tử khối bằng 46. Công thức phân tử phù hợp của X là
Phân tử khối của các hợp chất:
C2H4.: 28
C2H4O2: 60
C2H6O: 46
C2H6: 30
Ở mỗi phát biểu, chọn đúng hoặc sai
Ở mỗi phát biểu sau, hãy chọn đúng hoặc sai:
(a) Sulfuric acid đặc có tính háo nước, gây bỏng nặng khi tiếp xúc với da tay. Đúng || Sai
(b) Khi pha loãng sulfuric acid đặc cần cho từ từ nước vào acid, không làm ngược lại gây nguy hiểm. Sai || Đúng
(c) Dung dịch sulfuric acid đặc có thể dùng để làm khô khí H2S, SO2. Sai || Đúng
(d) Sulfuric acid loãng có tính oxi hóa mạnh, khi tác dụng với kim loại không sinh ra khí hydrogen. Sai || Đúng
Ở mỗi phát biểu sau, hãy chọn đúng hoặc sai:
(a) Sulfuric acid đặc có tính háo nước, gây bỏng nặng khi tiếp xúc với da tay. Đúng || Sai
(b) Khi pha loãng sulfuric acid đặc cần cho từ từ nước vào acid, không làm ngược lại gây nguy hiểm. Sai || Đúng
(c) Dung dịch sulfuric acid đặc có thể dùng để làm khô khí H2S, SO2. Sai || Đúng
(d) Sulfuric acid loãng có tính oxi hóa mạnh, khi tác dụng với kim loại không sinh ra khí hydrogen. Sai || Đúng
(a) đúng.
(b) sai. Khi pha loãng sulfuric acid đặc cần cho từ từ acid vào nước, không làm ngược lại gây nguy hiểm.
(c) sai. Khí H2S có tính khử mạnh có thể tác dụng với dung dịch H2SO4 đặc → không dùng dung dịch sulfuric acid đặc để làm khô.
(d) sai. Sulfuric acid loãng khi tác dụng với kim loại sinh ra khí hydrogen.
Ở mỗi phát biểu, chọn đúng hoặc sai
Ở mỗi phát biểu sau, hãy chọn đúng hoặc sai:
(1) Sử dụng phương pháp kết tinh để làm đường cát, đường phèn từ nước mía. Đúng || Sai
(2) Để thu được tinh dầu sả người ta dùng phương pháp chưng cất lôi cuốn hơi nước. Đúng || Sai
(3) Để tách các chất có độ hòa tan khác nhau trong các môi trường không tan vào nhau, người ta dùng phương pháp kết tinh. Sai || Đúng
(4) Mật ong để lâu thường có những hạt rắn xuất hiện ở đáy chai do có sự kết tinh đường. Đúng || Sai
Ở mỗi phát biểu sau, hãy chọn đúng hoặc sai:
(1) Sử dụng phương pháp kết tinh để làm đường cát, đường phèn từ nước mía. Đúng || Sai
(2) Để thu được tinh dầu sả người ta dùng phương pháp chưng cất lôi cuốn hơi nước. Đúng || Sai
(3) Để tách các chất có độ hòa tan khác nhau trong các môi trường không tan vào nhau, người ta dùng phương pháp kết tinh. Sai || Đúng
(4) Mật ong để lâu thường có những hạt rắn xuất hiện ở đáy chai do có sự kết tinh đường. Đúng || Sai
(1) đúng.
(2) đúng.
(3) sai. Để tách các chất có độ hòa tan khác nhau trong các môi trường không tan vào nhau, người ta dùng phương pháp chiết.
(4) đúng.
Ở mỗi phát biểu, chọn đúng hoặc sai
Ở mỗi phát biểu sau, hãy chọn đúng hoặc sai:
(a) Nitrogen là nguyên tố phổ biến thứ hai về thể tích trong khí quyển Trái Đất. Sai || Đúng
(b) Trong các phản ứng hóa học, ammonia thể hiện cả tính khử và tính oxi hóa. Sai || Đúng
(c) Trong phân tử NH3, nguyên tử N còn 1 cặp electron chưa tham gia liên kết. Đúng || Sai
(d) Khí ammonia làm quỳ tím ẩm chuyển sang màu xanh. Đúng || Sai
Ở mỗi phát biểu sau, hãy chọn đúng hoặc sai:
(a) Nitrogen là nguyên tố phổ biến thứ hai về thể tích trong khí quyển Trái Đất. Sai || Đúng
(b) Trong các phản ứng hóa học, ammonia thể hiện cả tính khử và tính oxi hóa. Sai || Đúng
(c) Trong phân tử NH3, nguyên tử N còn 1 cặp electron chưa tham gia liên kết. Đúng || Sai
(d) Khí ammonia làm quỳ tím ẩm chuyển sang màu xanh. Đúng || Sai
a) sai, vì nitrogen là nguyên tố phổ biến nhất trong khí quyển trái đất.
(b) sai, vì ammonia thể hiện tính khử.
(c) đúng.
(d) đúng.
Ở mỗi phát biểu, chọn đúng hoặc sai
Safrol hay safrole là một chất lỏng dạng dầu không màu hay có màu vàng nhạt. Thông thường nó được chiết ra từ vỏ rễ hay quả các loại de vàng, re hương. Nó có hương vị đặc trưng, được sử dụng như một loại phụ gia trong thực phẩm.
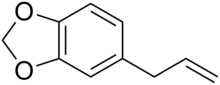
Ở mỗi phát biểu sau về safrol, hãy chọn đúng hoặc sai.
a) Công thức phân tử của safrol là C10H12O2. Sai || Đúng
(b) Trong safrol có bốn liên kết π (pi). Đúng || Sai
(c) Khối lượng phân tử của safrol là 160 (g/mol). Sai || Đúng
(d) Trong phân tử safrol có chứa nhóm chức alcohol. Sai || Đúng
Safrol hay safrole là một chất lỏng dạng dầu không màu hay có màu vàng nhạt. Thông thường nó được chiết ra từ vỏ rễ hay quả các loại de vàng, re hương. Nó có hương vị đặc trưng, được sử dụng như một loại phụ gia trong thực phẩm.

Ở mỗi phát biểu sau về safrol, hãy chọn đúng hoặc sai.
a) Công thức phân tử của safrol là C10H12O2. Sai || Đúng
(b) Trong safrol có bốn liên kết π (pi). Đúng || Sai
(c) Khối lượng phân tử của safrol là 160 (g/mol). Sai || Đúng
(d) Trong phân tử safrol có chứa nhóm chức alcohol. Sai || Đúng
a) sai. Công thức phân tử của safrol là C10H10O2.
b) đúng.
c) sai. Khối lượng phân tử của safrol là M = 12.10 + 10 + 16.2 = 162 (g/mol).
d) sai. Trong phân tử safrol không chứa nhóm chức alcohol.
Phân biệt các dung dịch
Bằng phương pháp hóa học, hãy phân biệt các dung dịch sau: Na2SO4, NaOH, H2SO4, HCl. Viết phương trình chứng minh (nếu có).
Bằng phương pháp hóa học, hãy phân biệt các dung dịch sau: Na2SO4, NaOH, H2SO4, HCl. Viết phương trình chứng minh (nếu có).
Nhúng quỳ tím vào 4 mẫu thử:
- 2 mẫu làm quỳ chuyển đỏ là H2SO4 và HCl (nhóm A).
- Mẫu làm quỳ chuyển xanh là NaOH.
- Mẫu không làm quỳ chuyển màu là là Na2SO4.
Nhỏ dung dịch BaCl2 lần lượt vào 2 mẫu ở nhóm A:
- Mẫu có kết tủa trắng là H2SO4:
BaCl2 + H2SO4 → BaSO4↓ + 2HCl
- Mẫu còn lại là HCl không có hiện tượng.
Xác định giá trị của n
Hòa tan 6,76 gam oleum H2SO4.nSO3 vào nước thu được 200 ml dung dịch H2SO4; 10 ml dung dịch này trung hòa vừa hết 16 ml NaOH 0,5 M. Xác định giá trị của n.
H2SO4.nSO3 + H2O → (n + 1)H2SO4
Trong 10 ml dung dịch:
⇒ Trong 200 ml dung dịch chứa 0,08 mol H2SO4.
Tính hiệu suất của phản ứng
Cho vào bình kín dung tích 2 L hỗn hợp gồm 2 mol N2 và 8 mol H2. Đun nóng với xúc tác thích hợp, khi đạt cân bằng, đưa về nhiệt độ ban đầu. Biết KC = 0,032, tính hiệu suất của phản ứng.
Cho vào bình kín dung tích 2 L hỗn hợp gồm 2 mol N2 và 8 mol H2. Đun nóng với xúc tác thích hợp, khi đạt cân bằng, đưa về nhiệt độ ban đầu. Biết KC = 0,032, tính hiệu suất của phản ứng.
Ban đầu: [N2] = 2/2 = 1 M; [H2] = 8/2 = 4 M.
N2 + 3H2 2NH3
Bđ (M): 1 4
Pư (M): x → 3x → 2x
Cb (M): 1 – x 4 – 3x 2x
⇒ x = 0,3584
Lập công thức phân tử của methyleugenol
Gọi công thức của methyleugenol là CxHyOz (x,y,z nguyên dương).
%mO = 100% – (74,16% + 7,86%) = 17,98%
⇒ x : y : z = 11 : 14 : 2
⇒ Công thức đơn giản nhất là: C11H14O2.
⇒ Ta có công thức phân tử là (C11H14O2)n.
Ta có: M(C11H14O2)n = 178n = 178 ⇒ n = 1.
Vậy công thức phân tử của methyleugenol là C11H14O2.
Viết phương trình hóa học xảy ra và tính % khối lượng
Cho 12 gam hỗn hợp Cu, Fe vào dung dịch HNO3 đặc nóng dư, sau phản ứng thu được 12,395 lít NO2 (đkc).
a) Viết các phương trình phản ứng xảy ra.
b) Tính thành phần phần trăm về khối lượng các kim loại ban đầu.
Cho 12 gam hỗn hợp Cu, Fe vào dung dịch HNO3 đặc nóng dư, sau phản ứng thu được 12,395 lít NO2 (đkc).
a) Viết các phương trình phản ứng xảy ra.
b) Tính thành phần phần trăm về khối lượng các kim loại ban đầu.
Gọi số mol của Fe và Cu trong hỗn hợp ban đầu lần lượt là x, y:
a)
Fe + 6HNO3 → Fe(NO3)3 + 3NO2 + 3H2O (1)
x → 3x
Cu + 4HNO3 → Cu(NO3)2 + 2NO2 + 2H2O (2)
y → 2y
b) Theo đề ta có nNO2 = 0,5 mol.
Ta có hệ phương trình:
⇒ x = y = 0,1 mol
%mCu = 53,33%
Tính phần trăm khối lượng của sulfur trong nhiên liệu
Hàm lượng cho phép của sulfur trong nhiên liệu là 0,3% về khối lượng. Để xác định hàm lượng sulfur trong một loại nhiên liệu người ta lấy 100,0 gam nhiên liệu đó và đốt cháy hoàn toàn. Khí tạo thành chỉ chứa carbon dioxide, sulfur dioxide và hơi nước được dẫn vào nước tạo ra 500,0 mL dung dịch. Biết rằng tất cả sulfur dioxide đã tan vào dung dịch. Lấy 10,0 mL dung dịch này cho tác dụng với dung dịch KMnO4 5,00.10–3 mol/L thì thể tích dung dịch KMnO4 cần dùng là 12,5 mL. Tính phần trăm khối lượng của sulfur trong nhiên liệu trên.
Hàm lượng cho phép của sulfur trong nhiên liệu là 0,3% về khối lượng. Để xác định hàm lượng sulfur trong một loại nhiên liệu người ta lấy 100,0 gam nhiên liệu đó và đốt cháy hoàn toàn. Khí tạo thành chỉ chứa carbon dioxide, sulfur dioxide và hơi nước được dẫn vào nước tạo ra 500,0 mL dung dịch. Biết rằng tất cả sulfur dioxide đã tan vào dung dịch. Lấy 10,0 mL dung dịch này cho tác dụng với dung dịch KMnO4 5,00.10–3 mol/L thì thể tích dung dịch KMnO4 cần dùng là 12,5 mL. Tính phần trăm khối lượng của sulfur trong nhiên liệu trên.
Lấy 10 ml dung dịch đem phản ứng thì:
nKMnO4 pư = 5,00.10–3.0,0125 = 6,25.10–5 (mol)
5SO2 + 2KMnO4 + 2H2O ⟶ K2SO4 + 2MnSO4 + 2H2SO4
mol: 1,5625.10–4 ⟵ 6,25.10–5
⇒ Trong 500 mL dung dịch: nS (SO2) = 1,5625.10–4.50 = 7,8125.10–3 (mol)
Theo Nghị định 147/2024/ND-CP, bạn cần xác thực tài khoản trước khi sử dụng tính năng này. Chúng tôi sẽ gửi mã xác thực qua SMS hoặc Zalo tới số điện thoại mà bạn nhập dưới đây:

