Giải SBT Hóa học 10 Kết nối tri thức bài 18
Với nội dung bài Giải sách bài tập Hoá học 10 bài 18: Ôn tập chương 5 sách Kết nối tri thức hay, chi tiết giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập trong SBT Hoá học 10.
Bài: Ôn tập chương 5
Nhận biết
Bài 18.1 trang 48 SBT Hóa học 10: Phát biểu nào sau đây không đúng?
A. Các phản ứng phân hủy thường là phản ứng thu nhiệt.
B. Phản ứng càng tỏa ra nhiều nhiệt càng dễ tự xảy ra.
C. Phản ứng oxi hóa chất béo cung cấp nhiệt cho cơ thể.
D. Các phản ứng khi đun nóng đều dễ xảy ra hơn.
Lời giải
Đáp án đúng là: D
Các phản ứng tỏa nhiệt như CO2 + CaO → CaCO3, phản ứng lên men, ... khó xảy ra hơn khi đun nóng.
Bài 18.2 trang 48 SBT Hóa học 10: Cho các phản ứng sau:

Ở 500K, 1 atm, biến thiên enthalpy của phản ứng (3) có giá trị là
A. -39,8 kJ
B. 39,8 kJ
C. -47,00 kJ
D. 106,7 kJ
Lời giải
Đáp án đúng là: A
Lấy phương trình phản ứng (2) trừ phương trình phản ứng (1) được phương trình phản ứng (3).

Bài 18.3 trang 49 SBT Hóa học 10: Cho sơ đồ hòa tan NH4NO3 sau:
NH4NO3 (s) + H2O(l) → NH4NO3 (aq) ∆H = +26 kJ
Hòa tan 80 g NH4NO3 khan vào bình chứa 1 L nước ở 25oC. Sau khi muối tan hết, nước trong bình có nhiệt độ là
A. 31,2oC
B. 28,1oC
C. 21,9oC
D. 18,8oC
Lời giải
Đáp án đúng là: D
80g NH4NO3 ~ 1 mol ⇒ Q = 26 (kJ)
∆H > 0, quá trình hòa tan thu nhiệt, nhiệt độ giảm đi một lượng là:
![]()
(Với 4,2 (J/g.K) là nhiệt dung riêng của nước)
⇒ Nhiệt độ cuối cùng là 25 – 6,2 = 18,8oC
Bài 18.4 trang 49 SBT Hóa học 10: Cho phương trình phản ứng
Zn(r) + CuSO4(aq) → ZnSO4(aq) + Cu(s) ∆H = -210 kJ
Và các phát biểu sau:
(1) Zn bị oxi hóa;
(2) Phản ứng trên tỏa nhiệt;
(3) Biến thiên enthalpy của phản ứng tạo thành 3,84g Cu là +12,6 kJ;
(4) Trong quá trình phản ứng, nhiệt độ hỗn hợp tăng lên.
Các phát biểu đúng là
A. (1) và (3).
B. (2) và (4).
C. (1), (2) và (4).
D. (1), (3) và (4).
Lời giải
Đáp án đúng là: C

+) Số oxi hóa của Zn tăng ⇒ Zn là chất khử (chất bị oxi hóa).
⇒ Phát biểu (1) đúng.
+) ∆H = -210 kJ < 0 ⇒ Phản ứng tỏa nhiệt ⇒ Phát biểu (2) đúng.
+) Biến thiên enthalpy của phản ứng tạo thành 1 mol Cu ~ 64 gam Cu là ∆H = -210 kJ
⇒ Biến thiên enthalpy của phản ứng tạo thành 3,84 g Cu là:

+) Phản ứng tỏa nhiệt ⇒ Trong quá trình phản ứng, nhiệt độ hỗn hợp tăng lên.
⇒ Phát biểu (4) đúng.
Bài 18.5 trang 49 SBT Hóa học 10: Cho phương trình nhiệt hóa học của phản ứng trung hòa sau:
HCl(aq) + NaOH(aq) → NaCl(aq) + H2O(l) ∆H = -57,3 kJ.
Phát biểu nào sau đây không đúng?
A. Cho 1 mol HCl tác dụng với NaOH dư tỏa nhiệt lượng là 57,3 kJ.
B. Cho HCl dư tác dụng với 1 mol NaOH thu nhiệt lượng là 57,3 kJ.
C. Cho 1 mol HCl tác dụng với 1 mol NaOH tỏa nhiệt lượng là 57,3 kJ.
D. Cho 2 mol HCl tác dụng với NaOH dư tỏa nhiệt lượng là 57,3 kJ.
Lời giải
Đáp án đúng là: B, D
∆H = -57,3 kJ < 0 ⇒ Phản ứng tỏa nhiệt (nhận định B không đúng)
2 mol HCl phản ứng ⇒ nhiệt lượng tỏa ra phải tăng gấp 2 lần (nhận định D không đúng).
Bài 18.6 trang 49 SBT Hóa học 10: Phản ứng đốt cháy ethanol:
C2H5OH(l) + 3O2(g) → 2CO2(g) + 3H2O(g)
Đốt cháy hoàn toàn 5 g ethanol, nhiệt tỏa ra làm nóng chảy 447 g nước đá ở 0oC. Biết 1 g nước đá nóng chảy hấp thụ nhiệt lượng 333,5 J, biến thiên enthalpy của phản ứng đốt cháy ethanol là
A. -1 371 kJ/mol
B. -954 kJ/mol
C. -149 kJ/mol
D. +149 kJ/mol
Lời giải
Đáp án đúng là: A
447g nước đá nóng chảy cần nhiệt lượng là:
Q = 447.333,5 = 149 074,5 J ≈ 149 (kJ).
⇒ Đốt cháy hoàn toàn 5 g ethanol tỏa ra 149 kJ nhiệt lượng.
⇒ Biến thiên enthalpy của phản ứng đốt cháy 1 mol ethanol ~ 46 g ethanol à
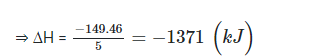
Bài 18.7 trang 49 SBT Hóa học 10: Phản ứng tổng hợp ammonia:
N2(g) + 3H2(g) → 2NH3(g) ∆H = -92 kJ
Biết năng lượng liên kết (kJ/mol) của N≡N và H-H lần lượt là 946 và 436. Năng lượng liên kết của N-H trong ammonia là
A. 391 kJ/mol
B. 361 kJ/mol
C. 245 kJ/mol
D. 490 kJ/mol
Lời giải
Đáp án đúng là: A
∆H = EN≡N + 3EH-H – 6EN-H
⇔ -92 = 946 + 3.436 – 6.EN-H
⇒ EN-H = 391 (kJ/mol)
Bài 18.8 trang 50 SBT Hóa học 10: Cho phương trình nhiệt hóa học sau:
H2(g) + I2(g) → 2HI(g) ∆H = +11,3 kJ.
Phát biểu nào sau đây về sự trao đổi năng lượng của phản ứng trên là đúng?
A. Phản ứng giải phóng nhiệt lượng 11,3 kJ khi 2 mol HI được tạo thành.
B. Tổng nhiệt phá vỡ liên kết của chất phản ứng lớn hơn nhiệt tỏa ra khi tạo thành sản phẩm.
C. Năng lượng chứa trong H2 và I2 cao hơn trong HI.
D. Phản ứng xảy ra với tốc độ chậm.
Lời giải
Đáp án đúng là: B
Phát biểu A sai: ∆H = +11,3 kJ > 0 ⇒ phản ứng thu nhiệt.
Phát biểu B đúng: phản ứng thu nhiệt nên tổng nhiệt cần cung cấp để phá vỡ liên kết lớn hơn nhiệt giải phóng khi tạo sản phẩm.
Phát biểu C sai: phân tử H2 và I2 có liên kết bền hơn HI, nghĩa là mức năng lượng thấp hơn.
Phát biểu D không nói về sự trao đổi năng lượng của phản ứng.
Bài 18.9 trang 50 SBT Hóa học 10: Làm các thí nghiệm tương tự nhau: Cho 0,05 mol mỗi kim loại Mg, Zn, Fe vào ba bình đựng 100 mL dung dịch CuSO4 0,5M.
Nhiệt độ tăng lên cao nhất ở mỗi bình lần lượt là ∆T1, ∆T2, ∆T3. Sự sắp xếp nào sau đây là đúng?
A. ∆T1 < ∆T2 < ∆T3
B. ∆T3 < ∆T1 < ∆T2
C. ∆T2 < ∆T3 < ∆T1
D. ∆T3 < ∆T2 < ∆T1
Lời giải
Đáp án đúng là: D
Cả ba kim loại Mg, Zn, Fe đều tác dụng với CuSO4 với cùng tỉ lệ mol 1 : 1, kim loại càng mạnh thì càng tỏa nhiều nhiệt.
Do Mg > Zn > Fe nên nhiệt độ tăng cao nhất ở bình có Mg, rồi đến Zn, Fe.
Thông hiểu
Bài 18.10 trang 50 SBT Hóa học 10: Cho 0,5 g bột iron vào bình đựng 25 mL dung dịch CuSO4 0,2M ở 32oC. Khuấy đều dung dịch, quan sát nhiệt kế thấy nhiệt độ lên cao nhất là 39oC. Tính nhiệt của phản ứng. (Giả thiết nhiệt lượng của phản ứng tỏa ra được dung dịch hấp thụ hết, nhiệt dung của dung dịch loãng bằng nhiệt dung của nước (4,2 J/g.K)).
Lời giải
Nhiệt lượng tỏa ra là:
Q = m.c. ∆T = 25.4,2.(39 – 32) = 735 (J)
Phản ứng xảy ra:
Fe(s) + CuSO4 (aq) → FeSO4(aq) + Cu(s)

Bài 18.11 trang 50 SBT Hóa học 10: Để làm nóng khẩu phần ăn, người ta dùng phản ứng giữa CaO với H2O:
CaO(s) + H2O(l) → Ca(OH)2(aq) ∆H = -105 kJ
Cần cho bao nhiêu gam CaO vào 250g H2O để nâng nhiệt độ từ 20oC lên 80oC?
Lời giải
Q = m.c. ∆T = 250.4,2.(80 – 20) = 63 000 J = 63 (kJ)
1 mol CaO tương đương 56 gam CaO phản ứng tỏa ra nhiệt lượng là 105 kJ
Số gam CaO cần để tỏa ra nhiệt lượng 63 kJ là

Bài 18.12 trang 50 SBT Hóa học 10: Tính nhiệt tỏa ra khi đốt cháy hoàn toàn 12 kg khí methane (CH4), biết nhiệt tạo thành của các chất như sau:
Chất | CH4(k) | CO2(k) | H2O(l) |
∆rH (kJ/mol) | -75 | -392 | -286 |
Lời giải
CH4(k) + 2O2(k) → CO2(k) + 2H2O(k)

Đốt cháy hoàn toàn 1 mol ~ 16 gam khí methane (CH4) tỏa ra một lượng nhiệt là 889 (kJ).
⇒ Khi đốt cháy hoàn toàn 12 kg khí methane (CH4) tỏa ra

Bài 18.13 trang 51 SBT Hóa học 10: Cho 1,5 g bột Mg (dư) vào 100 mL dung dịch HCl 1M, sau khi phản ứng hoàn toàn, nhiệt độ dung dịch tăng lên 8,3oC. Biết nhiệt dung riêng của H2O là 4,2 J/g.K, hãy tính nhiệt lượng của phản ứng.
Lời giải
Phản ứng xảy ra:
Mg(s) + 2HCl(aq) → MgCl2(aq) + H2(g)
Số mol HCl = 0,1 mol
Q = m.c.∆T = 100.4,2.8,3 = 3486 (J)
0,1 mol HCl phản ứng tỏa ra nhiệt lượng là 3486 (J)
2 mol HCl phản ứng tỏa ra nhiệt lượng là:
![]()
Bài 18.14 trang 51 SBT Hóa học 10: Một người thợ xây trong một buổi sáng kéo được 500 kg vật liệu xây dựng lên tầng cao 10 m. Để bù vào năng lượng đã tiêu hao, người đó cần uống cốc nước hòa tan m g glucose. Biết nhiệt tạo thành của glucose (C6H12O6), CO2 và H2O lần lượt là -1271, -393,5 và -285,8 kJ/mol. Giá trị của m là
A. 31,20
B. 3,15
C. 0,32
D. 314,70
Lời giải

Bài 18.15 trang 51 SBT Hóa học 10: Cho 16,5 g Zn vào 500 g dung dịch HCl 1M, dung dịch thu được có nhiệt độ tăng thêm 5oC. Xác định nhiệt lượng của phản ứng giữa Zn và HCl trong dung dịch. (Giả thiết không có sự thất thoát nhiệt ra ngoài môi trường, nhiệt dung của dung dịch loãng bằng nhiệt dung của nước (4,2 J/g.K)).
Lời giải
Nhiệt lượng của dung dịch nhận là:
Q = m.C.∆T = 500.4,4.5 = 10 500 (J) = 10,5 (kJ).
Phản ứng hóa học xảy ra:
Zn(s) + 2HCl(aq) → ZnCl2(aq) + H2(g)
Số mol HCl = 0,5 mol; số mol Zn = 0,254 mol
⇒ HCl hết, Zn phản ứng 0,25 mol
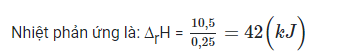
Bài 18.16 trang 51 SBT Hóa học 10: Cho phản ứng sau:
CH≡CH(g) + H2(g) → CH3-CH3(g)
Năng lượng liên kết (kJ.mol-1) của H-H là 436, của C-C là 347, của C-H là 414 và của C≡C là 839. Tính nhiệt (∆H) của phản ứng và cho biết phản ứng thu nhiệt hay tỏa nhiệt.
Lời giải
∆H = 2E(C-H) + E(C≡C) + 2E(H-H) – 6E(C-H) – E(C-C)
∆H = (2.414) + 839 + (2.436) – (6.414) – 347 = -292 (kJ/mol) < 0
⇒ Phản ứng tỏa nhiệt.
>>>> Bài tiếp theo: Giải SBT Hóa học 10 Kết nối tri thức bài 19
Như vậy, VnDoc đã gửi tới các bạn Giải SBT Hóa học 10 bài 18: Ôn tập chương 5. Ngoài ra, các em học sinh có thể tham khảo môn Ngữ văn 10 Kết nối tri thức tập 1, Vật Lý 10 Kết nối tri thức và Toán 10 Kết nối tri thức tập 1, Toán 10 Kết nối tri thức tập 2, Sinh 10 Kết nối tri thức đầy đủ khác.






