Giải Hóa 12 Chân trời sáng tạo bài 12
Giải Hóa 12 Chân trời sáng tạo bài 12: Thế điện cực và nguồn điện hoá học
VnDoc.com xin gửi tới bạn đọc bài viết Giải Hóa 12 Chân trời sáng tạo bài 12: Thế điện cực và nguồn điện hoá học. Bài viết hướng dẫn trả lời chi tiết các câu hỏi trong SGK Hóa học 12 Chân trời sáng tạo các trang 64, 65, 66, 67, 68, 69.
Giải Hóa 12 trang 64 Chân trời
Mở đầu trang 64 SGK Hóa 12
Người ta dùng hai sợi dây làm bằng hai kim loại khác nhau cắm vào một quả chanh và nối với một bóng đèn 3 V thì thấy bóng đèn sáng. Như vậy, quả chanh có cắm hai sợi dây kim loại khác nhau đóng vai trò như một viên pin, phát sinh ra dòng điện.
Cấu tạo và nguyên tắc hoạt động của pin như thế nào?
Lời giải:
- Cấu tạo của pin điện hoá: Pin Galvani là pin điện hoá có cấu tạo gồm hai điện cực, mỗi điện cực ứng với một cặp oxi hoá – khử và thường nối với nhau qua cầu muối.
- Nguyên tắc hoạt động của pin điện hoá: Trong pin điện hoá, quá trình oxi hoá và quá trình khử xảy ra trên hai điện cực và electron được truyền từ chất khử sang chất oxi hoá qua dây dẫn. Khi đó, năng lượng của phản ứng hoá học sẽ chuyển thành năng lượng điện.
Thảo luận 1 trang 64 SGK Hóa 12
Xác định dạng oxi hoá và dạng khử trong các quá trình (2) và (3).
Ví dụ 1:
Cu2+ + 2e ⇌ Cu (2)
Ag+ + 1e ⇌ Ag (3)
Lời giải:
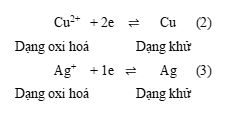
Thảo luận 2 trang 64 SGK Hóa 12
Viết các cặp oxi hoá – khử trong quá trình (2) và (3).
Ví dụ 1:
Cu2+ + 2e ⇌ Cu (2)
Ag+ + 1e ⇌ Ag (3)
Lời giải:
- Quá trình (2): Cu2+ + 2e ⇌ Cu
Cặp oxi hoá – khử: Cu2+/Cu.
- Quá trình (3): Ag+ + 1e ⇌ Ag
Cặp oxi hoá – khử: Ag+/Ag.
Luyện tập trang 64 SGK Hóa 12
Viết các cặp oxi hoá – khử của kim loại Na, Mg và Al.
Lời giải:
Các cặp oxi hoá – khử của kim loại Na, Mg và Al lần lượt là: Na+/Na; Mg2+/Mg và Al3+/Al.
Giải Hóa 12 trang 65 Chân trời
Thảo luận 3 trang 65 SGK Hóa 12
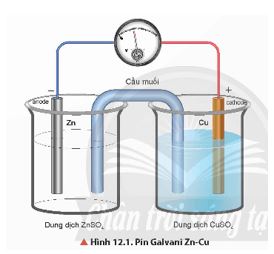
Quan sát Hình 12.1, hãy mô tả cấu tạo của pin Galvani. Cho biết cực dương, cực âm và chiều di chuyển của electron trong pin.
Lời giải:
- Cấu tạo của pin Galvani Zn – Cu: gồm điện cực kẽm và điện cực đồng được nối với nhau bởi cầu muối (thường chứa dung dịch KCl bão hoà).
- Điện cực âm, anode (-): Xảy ra quá trình oxi hoá Zn:
Zn → Zn2+ + 2e
- Điện cực dương, cathode (+): Xảy ra quá trình khử ion Cu2+:
Cu2+ + 2e → Cu
- Electron chuyển từ thanh Zn qua dây dẫn đến thanh Cu. Cầu muối đóng vai trò khép kín mạch và trung hoà điện tích của dung dịch ở hai điện cực.
Thảo luận 4 trang 65 SGK Hóa 12
Điện cực nào tan dần trong pin Galvani Zn – Cu?
Lời giải:
- Điện cực âm, anode (-): Xảy ra quá trình oxi hoá Zn:
Zn → Zn2+ + 2e
- Điện cực dương, cathode (+): Xảy ra quá trình khử ion Cu2+:
Cu2+ + 2e → Cu
Vậy điện cực âm tan dần.
Giải Hóa 12 trang 66 Chân trời
Thảo luận 5 trang 66 SGK Hóa 12
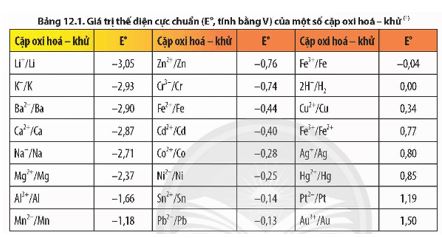
Dựa vào Bảng 12.1, hãy sắp xếp theo chiều tăng dần tính oxi hoá của các ion Li+, Fe2+, Ag+ và chiều tăng dần tính khử của các kim loại tương ứng.
Lời giải:
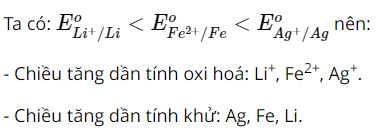
Giải Hóa 12 trang 67 Chân trời
Thảo luận 6 trang 67 SGK Hóa 12
Cho Al và Ag vào dung dịch HCl 1 M. Dựa vào Bảng 12.1, dự đoán phản ứng nào có thể xảy ra. Viết phương trình hoá học của phản ứng (nếu có).

Lời giải:

Thảo luận 7 trang 67 SGK Hóa 12
Dựa vào Bảng 12.1, xác định cathode và anode trong pin điện hoá Zn-Pb gồm điện cực chuẩn Zn 2+ /Zn và điện cực chuẩn Pb 2+ /Pb. Tính sức điện động chuẩn của pin.

Lời giải:
Anode: Zn
Cathode: Pb
Sức điện động chuẩn của pin:
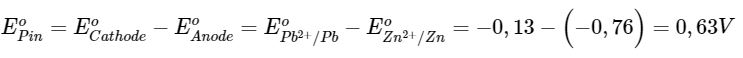
Giải Hóa 12 trang 68 Chân trời
Thảo luận 8 trang 68 SGK Hóa 12
Hãy nêu một số ứng dụng của pin mặt trời trong đời sống.
Lời giải:
Một số ứng dụng của pin mặt trời trong đời sống:
+ Trạm xe bus chiếu sáng tự động bằng pin mặt trời.
+ Ứng dụng pin mặt trời cho phương tiện giao thông.
+ Ứng dụng pin mặt trời cho trụ đèn đường, đèn giao thông.
+ Hệ thống nước nóng năng lượng mặt trời …
Thảo luận 9 trang 68 SGK Hóa 12
Hãy nêu một số thiết bị sử dụng acquy mà em biết.
Lời giải:
Một số thiết bị sử dụng acquy:
+ Xe đạp điện.
+ Xe điện đồ chơi dành cho trẻ em.
+ Quạt tích điện.
+ Đèn tích điện …
Thảo luận 10 trang 68 SGK Hóa 12
Tìm hiểu và nêu ưu, nhược điểm của pin nhiên liệu, pin mặt trời và acquy.
Lời giải:
|
|
Ưu điểm |
Nhược điểm |
|
Pin nhiên liệu |
Tạo điện năng trực tiếp từ phản ứng hoá học nên có hiệu suất chuyển hoá từ nhiên liệu sang điện năng cao. Pin nhiên liệu hydrogen không tạo ra các sản phẩm gây ô nhiễm môi trường. |
Giá thành pin nhiên liệu cao vì cấu tạo phức tạp của pin (gồm các điện cực phủ xúc tác, lớp màng đặc biệt giữa hai điện cực, dung dịch trong pin…) cũng như phải có bộ phận lưu trữ nhiên liệu, đặc biệt là hydrogen. |
|
Pin mặt trời |
Sử dụng nguồn năng lượng vô tận là ánh sáng mặt trời, không tạo ra bất kì sản phẩm hoá học nào nên thân thiện với môi trường. |
Chỉ sinh ra dòng điện khi có ánh sáng mặt trời, công suất dòng điện tỉ lệ với cường độ ánh sáng. Khi pin hết hạn việc xử lí không đúng cách sẽ gây ô nhiễm môi trường đất. |
|
Acquy |
Vòng đời sử dụng được kéo dài do có thể nạp lại để tái sử dụng mà không cần phải thay thế viên pin . |
Chi phí sản xuất acquy thường lớn hơn so với pin thông thường; acquy cũ, hỏng không được thu gom và xử lí đúng cách sẽ gây ô nhiễm môi trường bởi các thành phần kim loại, hoá chất cũng như lớp vỏ của acquy (bằng nhựa khó phân huỷ). |
Giải Hóa 12 trang 69 Chân trời
Vận dụng trang 69 SGK Hóa 12
Lắp ráp thêm một số pin đơn giản từ các nguyên liệu khác và đo sức điện động của pin.
Lời giải:
Ví dụ: Lắp pin chuối
Chuẩn bị:
Hoá chất: các thanh kim loại: kẽm, đồng; quả chuối…
Dụng cụ: dây điện có sẵn kẹp cá sấu hai đầu, vôn kế.
Tiến hành:
- Cắm hai thanh kim loại vào quả chuối.
- Nối cực âm của vôn kế với thanh kẽm và cực dương của vôn kế với thanh đồng.
Chú ý: Không để hai thanh kim loại tiếp xúc với nhau.
Đo sức điện động của pin.
Bài tập 1 trang 69 SGK Hóa 12
Cho các kim loại: K, Mg, Al, Ag. Hãy viết các cặp oxi hoá – khử tạo bởi các kim loại đó và dựa vào bảng giá trị thế điện cực chuẩn, sắp xếp theo thứ tự giảm dần tính oxi hoá của các ion kim loại tương ứng.
Lời giải:
- Cặp oxi hoá – khử tạo bởi các kim loại K, Mg, Al, Ag lần lượt là: K+/K; Mg2+/Mg; Al3+/Al; Ag+/Ag.
- Dựa vào bảng thế điện cực chuẩn ta có: ![]()
Vậy, thứ tự giảm dần tính oxi hoá của các ion kim loại tương ứng: Ag+, Al3+, Mg2+, K+.
Bài tập 2 trang 69 SGK Hóa 12
Xác định chiều của các phản ứng hoá học xảy ra giữa các cặp oxi hoá – khử: Cu2+/Cu, Zn2+/Zn và Ag+/Ag ở điều kiện chuẩn. Giải thích và viết phương trình hoá học.
Lời giải:
Chiều của phản ứng hóa học xảy ra giữa các cặp oxi hóa – khử: Kim loại của cặp oxi hoá - khử có thế điện cực chuẩn nhỏ hơn có thể khử được cation kim loại của cặp oxi hoá - khử có thế điện cực chuẩn lớn hơn ở điều kiện chuẩn.
Ta có: 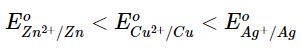
Các phương trình hoá học có thể xảy ra là:
Zn + Cu2+ → Zn2+ + Cu;
Zn + 2Ag+ → Zn2+ + 2Ag;
Cu + 2Ag+ → Cu2+ + 2Ag;
Bài tập 3 trang 69 SGK Hóa 12
Trong pin điện hoá, quá trình khử
A. xảy ra ở cực âm.
B. xảy ra ở cực dương.
C. xảy ra ở cực âm và cực dương.
D. không xảy ra ở cả cực âm và cực dương.
Lời giải:
Đáp án đúng là: B
Trong pin điện hoá, quá trình khử xảy ra ở cathode (điện cực dương).
Bài tập 4 trang 69 SGK Hóa 12
Khi pin Galvani Zn-Cu hoạt động thì nồng độ
A. Cu2+ giảm, Zn2+ tăng.
B. Cu2+ giảm, Zn2+ giảm.
C. Cu2+ tăng, Zn2+ tăng.
D. Cu2+ tăng, Zn2+ giảm.
Lời giải:
Đáp án đúng là: A
Phản ứng oxi hoá – khử xảy ra trong pin:
Zn + Cu2+ → Zn2+ + Cu
Vậy, khi pin Galvani Zn-Cu hoạt động thì nồng độ Cu2+ giảm, Zn2+ tăng.
Bài tập 5 trang 69 SGK Hóa 12
Cho một pin điện hoá được tạo bởi các cặp oxi hoá khử Fe2+/Fe, Ag+/Ag ở điều kiện chuẩn. Quá trình xảy ra ở cực âm khi pin hoạt động là
A. Fe → Fe2+ + 2e.
B. Fe2+ + 2e → Fe.
C. Ag+ + le → Ag.
D. Ag → Ag+ + le.
Lời giải:
Đang cập nhật...
Bài tập 6 trang 69 SGK Hóa 12
Dựa vào Bảng 12.1, tính sức điện động chuẩn của các pin điện hoá tạo bởi các cặp oxi hoá – khử sau: Fe2+/Fe và Cu2+/Cu; Sn2+/Sn và Ag+/Ag; Pb2+/Pb và Ag+/Ag.
Lời giải:
Đang cập nhật...
Bài tiếp theo: Giải Hóa 12 Chân trời sáng tạo bài 13










