Giải Hóa 12 Kết nối tri thức bài 19
Giải Hóa 12 Kết nối tri thức bài 19: Tính chất vật lí và tính chất hoá học của kim loại
Giải Hóa 12 Kết nối tri thức bài 19: Tính chất vật lí và tính chất hoá học của kim loại được VnDoc.com tổng hợp và xin gửi tới bạn đọc cùng tham khảo. Bài viết hướng dẫn trả lời chi tiết các câu hỏi trong SGK Hóa học 12 Kết nối tri thức trang 89, 90, 91, 92, 93. Mời các bạn cùng theo dõi bài viết dưới đây.
Giải Hóa 12 trang 89 Kết nối
Mở đầu trang 89 SGK Hóa học 12
Tại sao kim loại có thể được sử dụng làm dây dẫn điện, chế tạo dụng cụ đun nấu, dùng trong công trình xây dựng? Kim loại có những tính chất hoá học đặc trưng nào?
Lời giải:
- Nhờ tính dẫn điện tốt mà kim loại được sử dụng làm dây dẫn điện; nhờ tính dẫn nhiệt tốt mà kim loại được dùng để chế tạo dụng cụ đun nấu; nhờ tính cứng và bền mà kim loại được dùng trong các công trình xây dựng.
- Kim loại có các tính chất hoá học đặc trưng: tác dụng với phi kim, tác dụng với nước, tác dụng với dung dịch acid, tác dụng với dung dịch muối.
Giải Hóa 12 trang 90 Kết nối
Câu hỏi 1 trang 90 SGK Hóa học 12
Vì sao kim loại có tính dẻo?
Lời giải:
Kim loại có tính dẻo do các ion dương trong mạng tinh thể kim loại có thể trượt lên nhau mà không tách rời nhau nhờ lực hút tĩnh điện giữa chúng với các electron hoá trị tự do.
Câu hỏi 2 trang 90 SGK Hóa học 12
a) Hãy nêu sự khác biệt giữa liên kết kim loại và liên kết cộng hoá trị.
b) Vì sao kim loại có tính dẫn điện, trong khi hầu hết các phi kim không dẫn điện?
Lời giải:
a) Sự khác biệt giữa liên kết kim loại và liên kết cộng hoá trị:
- Liên kết kim loại: sự dùng chung electron giữa các nguyên tử kim loại.
- Liên kết cộng hoá trị: sự dùng chung electron giữa hai nguyên tử tham gia liên kết.
b) Khi một hiệu điện thế được áp vào thanh kim loại, các electron tự do trong mạng tinh thể sẽ di chuyển thành dòng từ phía cực âm về cực dương. Hệ quả là thanh kim loại trở thành vật dẫn điện.
Câu hỏi 3 trang 90 SGK Hóa học 12
Vì sao kim loại có tính dẫn nhiệt tốt? Hãy nêu một số ứng dụng của kim loại dựa trên tính dẫn nhiệt của chúng.
Lời giải:
Tính dẫn nhiệt của các kim loại được giải thích bằng sự có mặt của các electron tự do trong mạng tinh thể. Khi đốt nóng một đầu của thanh kim loại thì động năng của các electron trong vùng đó tăng lên. Các electron này truyền động năng của chúng cho các ion dương ở nút mạng và các electron khác trong toàn thanh kim loại thông qua va chạm, làm cho nhiệt được lan truyền trong toàn bộ thanh kim loại.
Một số ứng dụng của kim loại dựa trên tính dẫn nhiệt của chúng: chế tạo dụng cụ đun nấu, chế tạo bộ phận tản nhiệt trong các thiết bị …
Câu hỏi 4 trang 90 SGK Hóa học 12
Vì sao kim loại có tính ánh kim? Hãy nêu một số ứng dụng của kim loại dựa trên tính ánh kim của chúng.
Lời giải:
Các electron tự do trong tinh thể kim loại phản xạ hầu hết những tia sáng nhìn thấy được, do đó kim loại có vẻ sáng lấp lánh, gọi là ánh kim.
Nhờ tính ánh kim mà kim loại được dùng để chế tạo trang sức, đồ vật trang trí …
Giải Hóa 12 trang 91 Kết nối
Hoạt động trang 91 SGK Hóa học 12
Hãy tìm hiểu và trình bày một số ứng dụng của kim loại có nhiệt độ nóng chảy cao và kim loại có độ cứng lớn.
Lời giải:
- Do có nhiệt độ nóng chảy cao, tungsten (vonfram) được sử dụng làm dây tóc bóng đèn trong bóng đèn sợi đốt.
- Vì rất cứng nên chromium là kim loại được mạ bên ngoài các sản phẩm để bảo vệ sản phẩm và hạn chế sự mài mòn.
Hoạt động thí nghiệm trang 91 SGK Hóa học 12
Kim loại tác dụng với phi kim
Chuẩn bị:
Hoá chất: dây magnesium (Mg), nhôm bột, lưu huỳnh bột.
Dụng cụ: kẹp sắt, ống nghiệm chịu nhiệt, đũa thuỷ tinh, đèn cồn.
Tiến hành:
1. Magnesium tác dụng với oxygen. Dùng kẹp sắt kẹp một mẩu dây magnesium (Mg) và đốt trên ngọn lửa đèn cồn.
2. Nhôm tác dụng với lưu huỳnh: Trộn đều bột nhôm và bột lưu huỳnh theo tỉ lệ khối lượng tương ứng khoảng 1 : 2. Lấy một thìa thuỷ tinh (khoảng 0,3 g) hỗn hợp vào ống nghiệm khô chịu nhiệt. Hơ nóng đều ống nghiệm trên ngọn lửa đèn cồn, sau đó đun tập trung vào phần ống nghiệm chứa hỗn hợp.
Thực hiện yêu cầu sau:
Hãy mô tả hiện tượng quan sát được và viết phương trình hoá học của các phản ứng xảy ra.
Lời giải:
|
Thí nghiệm |
Hiện tượng |
Phương trình hoá học |
|
Magnesium tác dụng với oxygen |
Sợi dây magnesium cháy mãnh liệt cho ngọn lửa sáng chói. |
2Mg + O2 |
|
Nhôm tác dụng với lưu huỳnh |
Hỗn hợp cháy sáng, phản ứng toả nhiều nhiệt. |
2Al + 3S |
Giải Hóa 12 trang 92 Kết nối
Câu hỏi 5 trang 92 SGK Hóa học 12
Khi tác dụng với phi kim, kim loại thể hiện tính chất hoá học gì? Minh hoạ bằng các phương trình hoá học.
Lời giải:
Khi tác dụng với phi kim, kim loại thể hiện tính khử.
Ví dụ:
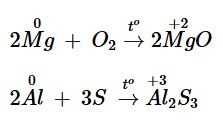
Câu hỏi 6 trang 92 SGK Hóa học 12
Hãy cho biết kim loại nào trong Bảng 15.1 có thể phản ứng với nước ở nhiệt độ thường giải phóng khí hydrogen.
Lời giải:
Những kim loại có thế điện cực chuẩn ![]() \(E_{M^{n+}/M }^{0}\) nhỏ hơn -0,414 có thể đẩy được hydrogen ra khỏi nước.
\(E_{M^{n+}/M }^{0}\) nhỏ hơn -0,414 có thể đẩy được hydrogen ra khỏi nước.
Quan sát Bảng 15.1 xác định được: Li, K, Ba, Ca, Na, Mg, Al, Zn, Cr, Fe có thể phản ứng với nước ở nhiệt độ thường giải phóng khí hydrogen.
Tuy nhiên chỉ có các kim loại Li, K, Ba, Ca, Na phản ứng nhanh với nước ở điều kiện thường, các kim loại còn lại phản ứng rất chậm hoặc gần như không xảy ra.
Hoạt động thí nghiệm trang 92 SGK Hóa học 12
Kim loại tác dụng với dung dịch acid loãng
Chuẩn bị:
Hoá chất: dung dịch H2SO4 10%, kẽm hạt.
Dụng cụ: ống nghiệm, kẹp gỗ.
Tiến hành:
Cho vài hạt kẽm vào ống nghiệm. Thêm tiếp khoảng 2 mL dung dịch H2SO4 10%.
Thực hiện yêu cầu sau:
Hãy mô tả hiện tượng quan sát được và viết phương trình hoá học.
Lời giải:
Hiện tượng: Hạt kẽm tan dần, có khí thoát ra.
Phương trình hoá học:
Zn(s) + H2SO4(aq) → ZnSO4(aq) + H2(g)
Giải Hóa 12 trang 93 Kết nối
Câu hỏi 7 trang 93 SGK Hóa học 12
Các kim loại từ Cu đến Au trong dãy điện hóa không đẩy được H2 ra khỏi dung dịch của các acid như HCl, H2SO4 loãng. Hãy dựa vào thế điện cực chuẩn của các cặp oxi hóa – khử tương ứng để giải thích.
Lời giải:
Ta có:
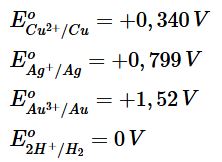
Nhận thấy thế điện cực chuẩn của các cặp oxi hóa – khử này lớn hơn rất nhiều so với thế điện cực chuẩn của hydrogen nên các kim loại từ Cu đến Au trong dãy điện hóa không đẩy được H2 ra khỏi dung dịch của các acid như HCl, H2SO4 loãng.
Hoạt động thí nghiệm trang 93 SGK Hóa học 12
Kim loại tác dụng với dung dịch muối
Chuẩn bị:
Hoá chất: đinh sắt mới (đã rửa sạch lớp dầu mỡ), dung dịch CuSO4 1 M.
Dụng cụ: cốc thuỷ tinh, kẹp sắt.
Tiến hành:
Cho đinh sắt vào cốc. Thêm tiếp 2 - 3 ml dung dịch CuSO4 1M.
Sau 5 phút dùng kẹp lấy đinh sắt ra khỏi dung dịch.
Thực hiện yêu cầu sau:
Mô tả hiện tượng xảy ra, giải thích và viết phương trình hoá học.
Lời giải:
Hiện tượng: Dung dịch nhạt màu dần, có lớp kim loại màu đỏ đồng bám ngoài đinh sắt.
Giải thích: Kim loại sắt hoạt động hoá học mạnh hơn kim loại đồng nên có thể đẩy được đồng ra khỏi dung dịch muối của nó.
Phương trình hoá học: Fe + CuSO4 → FeSO4 + Cu.
Em có thể trang 93 SGK Hóa học 12
- Giải thích được các ứng dụng của kim loại dựa trên tính chất vật lí của chúng.
- Giải thích được vì sao các vật bằng sắt thép bị phá huỷ nhanh hơn trong môi trường acid loãng, còn vật bằng đồng thì khó bị phá huỷ hơn.
Lời giải:
- Nhờ tính dẫn điện tốt kim loại được sử dụng làm dây dẫn điện; nhờ tính dẫn nhiệt tốt mà kim loại được dùng để chế tạo dụng cụ đun nấu; nhờ tính ánh kim mà kim loại được sử dụng để làm đồ trang sức, nhờ tính cứng và bền mà kim loại được dùng trong các công trình xây dựng…
- Sắt hoạt động hoá học mạnh hơn đồng; ngoài ra, sắt tác dụng được với dung dịch acid như HCl, H2SO4 loãng… ở điều kiện thường còn đồng thì không, do đó các vật bằng sắt thép bị phá huỷ nhanh hơn trong môi trường acid loãng, còn vật bằng đồng thì khó bị phá huỷ hơn.
Bài tiếp theo: Giải Hóa 12 Kết nối tri thức bài 20









