Giải Hóa 12 Cánh diều bài 12
Giải Hóa 12 Cánh diều bài 12: Điện phân
VnDoc.com xin gửi tới bạn đọc bài viết Giải Hóa 12 Cánh diều bài 12: Điện phân để bạn đọc cùng tham khảo. Bài viết hướng dẫn trả lời chi tiết các câu hỏi trong SGK Hóa học 12 Cánh diều các trang 83, 84, 85, 86, 87, 88.
Giải Hóa 12 trang 83 Cánh diều
Mở đầu trang 83 SGK Hóa 12
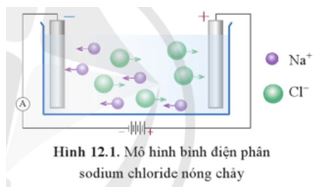
Hình 12.1 mô tả sự chuyển động của các ion về các điện cực trong bình điện phân.
a) Giải thích sự chuyển động của các ion về các điện cực.
b) Dự đoán quá trình oxi hoá, quá trình khử xảy ra ở điện cực nào.
Lời giải:
a) Trong điện trường, các ion sẽ di chuyển về các cực trái dấu. Ion dương Na+ di chuyển về phía cực âm, ion âm Cl- di chuyển về phía cực dương.
b) Quá trình oxi hoá, quá trình khử xảy:

Giải Hóa 12 trang 84 Cánh diều
Câu hỏi 1 trang 84 SGK Hóa 12
Vì sao phải điện phân NaCl ở trạng thái nóng chảy để điều chế Na? Có thể điện phân NaCl rắn được không?
Lời giải:
Phải điện phân NaCl ở trạng thái nóng chảy vì ở trạng thái nóng chảy NaCl mới điện li thành các ion Na+ và Cl-. Ở trạng thái rắn NaCl là chất không điện li.
Luyện tập 1 trang 84 SGK Hóa 12
Hãy viết phương trình hóa học của phản ứng điện phân xảy ra khi điện phân dung dịch CuCl2 bằng điện cực trơ (than chì).
Lời giải:
|
Trong dung dịch nước CuCl2 điện li thành Cu2+ và Cl− CuCl2(aq) ⟶ Cu2+(aq) + 2Cl−(aq) |
|
|
Tại điện cực âm (cathode) có ion Cu2+ và H2O. Vì Cu2+ dễ nhận electron hơn H2O (bản chất là H+ của phân tử H2O) nên ưu tiên xảy ra quá trình: Cu2+(aq) + 2e ⟶ Cu(s) |
Tại điện cực dương (anode) có Cl- và H2O. Trong điều kiện này, Cl- được ưu tiên điện phân trước theo quá trình: 2Cl−(aq) ⟶ Cl2(g) + 2e |
|
Phương trình hóa học của phản ứng điện phân: CuCl2(aq) ⟶ Cu(s) + Cl2(g) |
|
Giải Hóa 12 trang 85 Cánh diều
Câu hỏi 2 trang 85 SGK Hóa 12
Đối với quá trình điện phân dung dịch NaCl bão hoà không có màng ngăn:
a) Hãy viết các quá trình oxi hoá và quá trình khử tại mỗi điện cực. Viết phương trình hoá học của quá trình điện phân.
b) Vì sao sản phẩm thu được trong Thí nghiệm 1 là nước Javel (chứa NaOCl) mà không phải là NaOH? Giải thích.
Lời giải:
a) Điện cực âm (cathode), quá trình oxi hóa: 2H2O(l) + 2e ⟶ H2(g) + 2OH−(aq)
Điện cực dương(anode), quá trình khử: 2Cl−(aq) ⟶ Cl2(g) + 2e
Phương trình hoá học của quá trình điện phân:
2NaCl(aq) + 2H2O(l) → 2NaOH(aq) + Cl2(g) + H2(g)
b) Khí Cl2 sinh ra nhưng vì không có màng ngăn nên Cl2 phản ứng với NaOH (sinh ra ở cathode) thu được nước Javel (chứa NaOCl).
2NaOH(aq) + Cl2(aq) ⟶ NaOCl(aq) + NaCl(aq) + H2O(l)
Thí nghiệm 1 trang 85 SGK Hóa 12
Điện phân dung dịch sodium chloride không màng ngăn để điều chế nước Javel
Chuẩn bị:
- Hoá chất: Dung dịch NaCl bão hoà.
- Dụng cụ: Cốc thuỷ tinh loại 100 mL, hai điện cực than chì, nguồn điện một chiều 6 V (hoặc pin 6 V), dây dẫn điện.
Tiến hành: Nhúng hai điện cực vào cốc đựng khoảng 60 mL dung dịch NaCl bão hoà, rồi nối hai điện cực với nguồn điện bằng dây dẫn điện để tiến hành điện phân. Thời gian điện phân tối thiểu là 5 phút.
Yêu cầu: Quan sát và mô tả hiện tượng xảy ra.
Chú ý: Không để hai điện cực đã nối nguồn điện chạm vào nhau; đeo khẩu trang và thực hiện thí nghiệm ở nơi thoáng khí hoặc trong tủ hút.
Lời giải:
Tại điện cực âm (cathode) có khí H2 không màu sinh ra đồng thời tại điện cực dương (anode) có khí Cl2 sinh ra nhưng vì không có màng ngăn nên Cl2 phản ứng với NaOH sinh ra ở cathode thu được nước Javel.
2NaCl(aq) + 2H2O(l) ⟶ H2(g) + Cl2(g) + 2NaOH(aq)
2NaOH(aq) + Cl2(aq) ⟶ NaOCl(aq) + NaCl(aq) + H2O(l)
Thí nghiệm 2 trang 85 SGK Hóa 12
Điện phân dung dịch copper(II) sulfate
Chuẩn bị:
- Hoá chất: Dung dịch CuSO4 0,5 M.
- Dụng cụ: Cốc thuỷ tinh loại 100 mL, hai điện cực than chì, nguồn điện một chiều 6 V (hoặc pin 6V), dây dẫn điện.
Tiến hành: Nhúng hai điện cực vào cốc đựng khoảng 60 mL dung dịch CuSO4 0,5M rồi nối hai điện cực với nguồn điện để tiến hành điện phân. Thời gian điện phân tối thiểu là 5 phút.
Yêu cầu: Quan sát và mô tả hiện tượng xảy ra.
Chú ý: Không để hai điện cực đã nối nguồn điện chạm vào nhau.
Lời giải:
Hiện tượng: Màu xanh lam của dung dịch CuSO4 nhạt dần, có khí không màu (O2) thoát ra ở anode, kim loại màu đỏ được sinh ra bám vào cathode.
Giải thích:
|
Trong dung dịch nước CuSO4 điện li thành Cu2+ và SO42- CuSO4(aq) ⟶ Cu2+(aq) + SO42-(aq) |
|
|
Tại điện cực âm (cathode) có ion Cu2+ và H2O. Vì Cu2+ dễ nhận electron hơn H2O (bản chất là H+ của phân tử H2O) nên ưu tiên xảy ra quá trình: Cu2+(aq) + 2e ⟶ Cu(s) |
Tại điện cực dương (anode) có SO42- và H2O. Trong điều kiện này, H2O được ưu tiên điện phân trước theo quá trình: H2O(aq) ⟶ 1 2 12 O2(g) + 2H+ + 2e |
|
Phương trình hóa học của phản ứng điện phân: CuSO4(aq) + H2O(aq) ⟶ Cu(s) + 1 2 12 O2(g) + H2SO4 |
|
Vận dụng 1 trang 85 SGK Hóa 12
Tìm hiểu ứng dụng của nước Javel. Đề xuất thí nghiệm đơn giản để chứng minh rằng dung dịch nước Javel có tính tẩy màu.
Lời giải:
- Ứng dụng của nước Javel:
+ Tẩy các vết bẩn trên quần áo, vải.
+ Khử trùng toilet, bồn cầu.
+ Khử trùng đồ gia dụng.
+ Vệ sinh nhà cửa.
+ Khử trùng hồ bơi.
+ Tẩy sạch sàn nhà
+ Tẩy vết bẩn trên áo, ga, thảm.
+ Khử trùng môi trường lỏng (khử trùng nguồn nước bị bẩn hay ô uế).
- Thí nghiệm đơn giản để chứng minh rằng dung dịch nước Javel có tính tẩy màu là sử dụng cánh hoa hồng, dung dịch nước Javel làm mất màu cánh hoa hồng.
Câu hỏi 3 trang 85 SGK Hóa 12
Cho biết trong Thí nghiệm 2, tại điện cực dương, H2O điện phân trước ion SO42- theo quá trình sau: 2H2O ⟶ O2 + 4H+ + 4e
Xác định các sản phẩm thu được trong Thí nghiệm 2. Viết phương trình hoá học của quá trình điện phân.
Lời giải:
- Sản phẩm thu được trong thí nghiệm 2: dung dịch H2SO4, khí không màu (O2) thoát ra ở anode, kim loại màu đỏ được sinh ra bám vào cathode.
- Phương trình hoá học của quá trình điện phân:
CuSO4(aq) + H2O(aq) ⟶ Cu(s) + ![]() \(\frac{1}{2}\)O2(g) + H2SO4
\(\frac{1}{2}\)O2(g) + H2SO4
Luyện tập 2 trang 85 SGK Hóa 12
Hãy sắp xếp thứ tự điện phân các ion dương ở cực âm khi tiến hành điện phân dung dịch gồm: FeCl2 1 M, CuCl2 1 M và HCl 1M.
Lời giải:
* Ở cực âm, chất có tính oxi hóa mạnh hơn (dễ nhận electron hơn) được ưu tiên điện phân trước.
Sắp xếp thứ tự điện phân các ion dương ở cực âm: Cu2+, H+, Fe2+
Giải Hóa 12 trang 86 Cánh diều
Vận dụng 2 trang 86 SGK Hóa 12
Hãy tìm hiểu và cho biết vì sao không điện phân nóng chảy AlCl3 trong sản xuất nhôm.
Lời giải:
Không điện phân nóng chảy AlCl3 trong sản xuất nhôm vì AlCl3 là chất thăng hoa nên khi đun nóng đến nhiệt độ nhất định AlCl3 sẽ bốc hơi.
Vận dụng 3 trang 86 SGK Hóa 12
Trong sản xuất nhôm bằng phương pháp điện phân, điện cực than chì được sử dụng ở cả cực dương và cực âm. Người ta nhận thấy, trong quá trình điện phân, điện cực dương bị hao mòn nhanh hơn điện cực âm. Hãy tìm hiểu và giải thích hiện tượng trên.
Lời giải:
Ở điện cực dương (anode), khí O2 tạo thành ở nhiệt độ cao, đốt cháy dần điện cực anode than chì thành CO và CO2. Do vậy trong quá trình điện phân, điện cực dương bị hao mòn nhanh hơn điện cực âm.
Giải Hóa 12 trang 87 Cánh diều
Vận dụng 4 trang 87 SGK Hóa 12
Tìm hiểu trong thực tế và chỉ ra những ví dụ về việc sử dụng mạ điện với mục đích bảo vệ, mạ điện với mục đích trang trí.
Lời giải:
- Mạ điện với mục đích bảo vệ: trong sản xuất vỏ hộp người ta mạ thiếc lên bề mặt thép để chống gỉ.
- Mạ điện với mục đích trang trí: mạ đồng hồ vàng, ấm trà mạ bạc, vòi nước mạ chromium…
Giải Hóa 12 trang 88 Cánh diều
Bài 1 trang 88 SGK Hóa 12
Chọn những phát biểu đúng:
(a) Phản ứng xảy ra trong pin điện hoá là tự diễn biến, trong bình điện phân là không tự diễn biến.
(b) Phản ứng xảy ra trong pin điện hoá là không tự diễn biến, trong bình điện phân là tự diễn biến.
(c) Cực dương của bình điện phân được gọi là anode, của pin điện hoá được gọi là cathode.
(d) Cực dương của bình điện phân được gọi là cathode, của pin điện hóa được gọi là anode.
Lời giải:
Những phát biểu đúng là: (a), (c)
- Trong pin điện hóa, điện năng được sinh ra từ phản ứng oxi hóa - khử tự diễn biến.
- Trong bình điện phân, phản ứng oxi hóa – khử không tự diễn biến, phản ứng oxi hóa khử xảy ra dưới tác dụng của dòng điện.
- Trong pin điện hóa: Cực âm (anode), cực dương (cathode)
- Trong bình điện phân: Cực âm (cathode), cực dương (anode).
Bài 2 trang 88 SGK Hóa 12
Xét quá trình sản xuất nhôm được thực hiện theo phương pháp điện phân Al2O3 nóng chảy với điện cực than chì.
a) Giải thích vì sao thực tế thành phần thể tích khí bay ra ở cực dương gồm CO (30% – 50%) và CO2 (70% – 50%) mà không phải là O2.
b) Trung bình để sản xuất được 1 tấn Al thì lượng điện cực than chì bị tiêu hao do phản ứng oxi hoá là bao nhiêu? Giả thiết thành phần khí bay ra ở cực dương gồm 50% CO và 50% CO2 về thể tích.
Lời giải:
Đang cập nhật...
Bài tiếp theo: Giải Hóa 12 Cánh diều bài 13










