Giải Hóa 12 Chân trời sáng tạo bài 19
Giải Hóa 12 Chân trời sáng tạo bài 19: Đại cương về kim loại chuyển tiếp dãy thứ nhất
Giải Hóa 12 Chân trời sáng tạo bài 19: Đại cương về kim loại chuyển tiếp dãy thứ nhất được VnDoc.com tổng hợp và xin gửi tới bạn đọc. Bài viết hướng dẫn trả lời chi tiết các câu hỏi trong SGK Hóa học 12 Chân trời sáng tạo các trang 110, 111, 112, 113, 114.
Giải Hóa 12 trang 110 Chân trời
Mở đầu trang 110 SGK Hóa học 12
Trong bảng tuần hoàn các nguyên tố hoá học, kim loại chuyển tiếp dãy thứ nhất bao gồm các nguyên tố từ Sc đến Cu. Cấu hình electron của nguyên tử các nguyên tố này có đặc điểm gì? Chúng có những tính chất vật lí và ứng dụng nào?
Lời giải:
- Cấu hình electron nguyên tử của các nguyên tố kim loại chuyển tiếp dãy thứ nhất có dạng [Ar]3d1÷104s1÷2
- Các kim loại chuyển tiếp dãy thứ nhất có nhiệt độ nóng chảy, khối lượng riêng, độ cứng cao hơn kim loại nhóm IA và nhóm IIA trong cùng chu kì.
- Hầu hết các kim loại chuyển tiếp dãy thứ nhất đều có ứng dụng trong nhiều lĩnh vực khác nhau. Ví dụ:
+ Đồng dùng trong sản xuất các thiết bị như: biến thế, cầu dao điện, dây dẫn điện …
+ Chromium dùng để mạ lên các thiết bị để chống mài mòn, chế tạo hợp kim đặc biệt.
+ Scandium, titanium dùng để chế tạo hợp kim ứng dụng trong hàng không, vũ trụ.
+ Vanadium được dùng trong các thiết bị chịu nhiệt.
+ Sắt được dùng chế tạo các hợp kim như gang, thép … dùng trong công nghiệp, nông nghiệp, đời sống.
+ Nikel được dùng chế tạo các hợp kim dùng trong máy móc, thiết bị.
+ …
Thảo luận 1 trang 110 SGK Hóa học 12
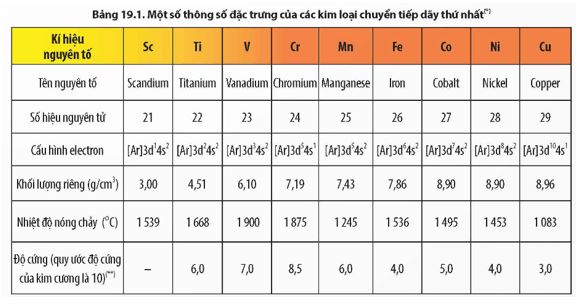
Quan sát Bảng 19.1, hãy cho biết đặc điểm cấu hình electron của các nguyên tử kim loại chuyển tiếp dãy thứ nhất.
Lời giải:
Cấu hình electron nguyên tử của các nguyên tố kim loại chuyển tiếp dãy thứ nhất có dạng [Ar]3d1÷104s1÷2
Giải Hóa 12 trang 111 Chân trời
Thảo luận 2 trang 111 SGK Hóa học 12
Dựa vào số liệu trong Bảng 19.1, Bảng 17.2 và Bảng 18.2, hãy nhận xét, so sánh nhiệt độ nóng chảy, khối lượng riêng, độ cứng của các kim loại chuyển tiếp dãy thứ nhất với kim loại K và Ca. Cho biết độ cứng của Ca là 1,75.
Lời giải:
Các kim loại chuyển tiếp dãy thứ nhất có nhiệt độ nóng chảy cao hơn, khối lượng riêng lớn hơn, độ cứng lớn hơn các kim loại K, Ca.
Giải Hóa 12 trang 112 Chân trời
Luyện tập trang 112 SGK Hóa học 12
Lấy một số ví dụ về ứng dụng của sắt trong thực tế.
Lời giải:
Một số ứng dụng của sắt trong thực tế:
+ Sắt được dùng chế tạo các đồ dùng cá nhân như dao, kéo, giá treo quần áo, kệ sắt, thìa, muỗng…
+ Sử dụng sắt để chế tạo các đồ nội thất như bàn ghế, tay nắm cửa, khung cửa, cầu thang, tủ…
+ Sắt được sử dụng để chế tạo một số bộ phận trong máy xay xát, máy giặt, bồn rửa…
+ Sắt, thép được dùng để tạo khung cho các công trình xây dựng …
Luyện tập trang 112 SGK Hóa học 12
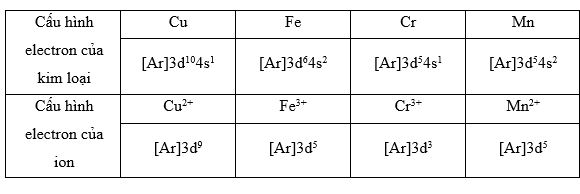
Hãy viết cấu hình electron của các ion: Cu2+, Fe3+, Cr3+, Mn2+.
Lời giải:
Để viết được cấu hình electron của ion cần xác định được cấu hình electron của kim loại, cụ thể trong bảng sau:
Thảo luận 3 trang 112 SGK Hóa học 12
Quan sát Hình 19.1, hãy nhận xét về màu sắc của các ion kim loại chuyển tiếp dãy thứ nhất.

Lời giải:
Trong dung dịch, ion của kim loại chuyển tiếp dãy thứ nhất thường có màu.
Giải Hóa 12 trang 113 Chân trời
Thảo luận 4 trang 113 SGK Hóa học 12
Dự đoán hiện tượng xảy ra trong thí nghiệm xác định hàm lượng muối Fe(II) bằng dung dịch thuốc tím.
Thí nghiệm: Xác định hàm lượng muối Fe(II) bằng dung dịch thuốc tím
Dụng cụ: bộ giá đỡ, bình định mức 100 mL, pipette 10 mL, burette 25 mL, bình tam giác, cốc thuỷ tinh, cân điện tử, thìa thuỷ tinh, quả bóp cao su.
Hoá chất: FeSO4.7H2O rắn, dung dịch KMnO4 0,02 M, dung dịch H2SO4 2 M, nước cất.
Tiến hành:
Bước 1: Cân khoảng 1,5 gam muối FeSO4.7H2O. Cho toàn bộ lượng muối vừa cân vào cốc thuỷ tinh, thêm khoảng 10 mL dung dịch H2SO4, khoảng 40 mL nước cất, khuấy đều cho muối tan hết. Sau đó chuyển dung dịch vào bình định mức 100 mL, dùng nước cất tráng sạch cốc cho tiếp vào bình và định mức đến vạch, lắc đều dung dịch.
Bước 2: Tráng sạch burette bằng nước cất, sau đó tráng lại bằng dung dịch KMnO4. Lắp burette vào giá đỡ, xoay vạch đọc thể tích về phía dễ quan sát. Cho dung dịch KMnO4 vào cốc thuỷ tinh, sau đó rót vào burette (đã khoá) và đưa mức dung dịch về vạch 0.
Bước 3: Dùng pipette lấy 10 ml dung dịch FeSO4 cho vào bình tam giác. Sau đó thêm vào bình khoảng 5 mL dung dịch H2SO4.
Bước 4: Mở khoá burete để nhỏ từ từ từng giọt dung dịch KMnO4 vào bình tam giác đựng dung dịch muối. Liên tục lắc đều bình tam giác. Khi toàn bộ dung dịch ở bình tam giác có màu hồng nhạt ổn định trong khoảng 20 giây thì dừng lại.
Bước 5: Đọc thể tích dung dịch KMnO4 đã sử dụng trên burete.
Bước 6: Lặp lại phép chuẩn độ thêm 2 lần. Lấy giá trị trung bình của 3 lần chuẩn độ.
Lời giải:
Hiện tượng xảy ra:
- Nhỏ từ từ từng giọt dung dịch KMnO4 (có màu tím) vào bình tam giác đựng dung dịch muối FeSO4 thấy màu tím bị mất.
- Khi toàn bộ dung dịch ở bình tam giác có màu hồng nhạt ổn định trong khoảng 20 giây thì dừng lại chứng tỏ FeSO4 đã phản ứng hết, KMnO4 dư (1-2 giọt).
Thảo luận 5 trang 113 SGK Hóa học 12
Từ kết quả chuẩn độ, xác định nồng độ Fe2+ trong dung dịch đã pha.
Lời giải:
Học sinh tiến hành thí nghiệm và xác định nồng độ Fe2+ trong dung dịch đã pha theo các bước sau:
Bước 1: Tính thể tích KMnO4 trung bình sau 3 lần chuẩn độ:
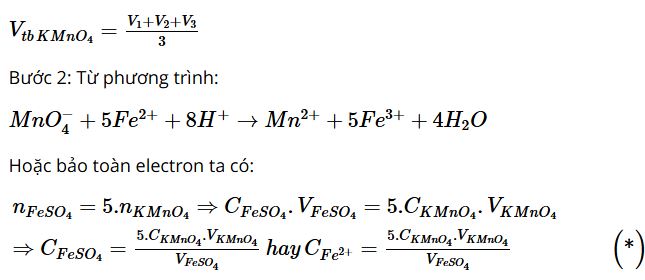
Tiến hành thay số liệu vào biểu thức (*) xác định nồng độ Fe2+ trong dung dịch đã pha.
Giải Hóa 12 trang 114 Chân trời
Thảo luận 6 trang 114 SGK Hóa học 12
Nêu hiện tượng quan sát được trong thí nghiệm nhận biết các ion Cu2+ và Fe3+, viết phương trình hoá học của phản ứng xảy ra và giải thích.
Lời giải:
|
Thí nghiệm |
Hiện tượng |
Giải thích, phương trình hoá học |
|
Nhận biết ion Cu2+ bằng dung dịch kiềm: Cho vào ống nghiệm khoảng 1 mL dung dịch CuSO4. Nhỏ từ từ từng giọt NaOH vào ống nghiệm. |
Xuất hiện kết tủa xanh. |
CuSO4 phản ứng với NaOH tạo thành kết tủa Cu(OH)2 có màu xanh. CuSO4 + 2NaOH → Cu(OH)2↓ + Na2SO4. |
|
Nhận biết ion Fe3+ bằng dung dịch kiềm: Cho vào ống nghiệm khoảng 1 mL dung dịch FeCl3. Nhỏ từ từ dung dịch NaOH vào ống nghiệm. |
Xuất hiện kết tủa nâu đỏ |
FeCl3 phản ứng với NaOH tạo thành kết tủa Fe(OH)3 có màu nâu đỏ. FeCl3 + 3NaOH → Fe(OH)3↓ + 3NaCl. |
Bài tập 1 trang 114 SGK Hóa học 12
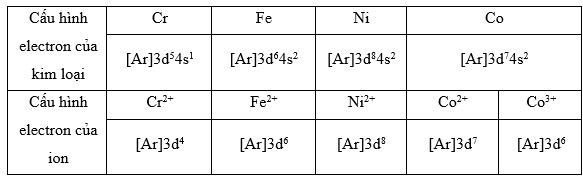
Viết cấu hình electron của các ion: Cr2+, Fe2+, Ni2+, Co2+, Co3+.
Lời giải:
Để viết được cấu hình electron của ion cần xác định được cấu hình electron của kim loại, cụ thể trong bảng sau:
Bài tập 2 trang 114 SGK Hóa học 12
Tìm hiểu qua sách, báo hoặc internet, hãy cho biết 5 kim loại có độ dẫn điện và dẫn nhiệt tốt nhất. Qua đó rút ra nhận xét về độ dẫn điện và dẫn nhiệt của các kim loại chuyển tiếp thuộc dãy thứ nhất.
Lời giải:
5 kim loại có độ dẫn điện, dẫn nhiệt tốt nhất: Ag, Cu, Au, Al, Na (hay silver, copper, gold, aluminium, sodium).
Nhận xét: Kim loại chuyển tiếp thuộc dãy thứ nhất có độ dẫn nhiệt, dẫn điện tốt.
Bài tập 3 trang 114 SGK Hóa học 12
Để xác định hàm lượng của FeCO3 trong quặng siderite, người ta có thể làm như sau: Cân 0,300 g mẫu quặng, xử lí theo một quy trình thích hợp, thu được dung dịch FeSO4 trong môi trường H2SO4 loãng. Coi như dung dịch không chứa tạp chất tác dụng với KMnO4. Chuẩn độ dung dịch thu được bằng dung dịch KMnO4 0,02 M thì dùng hết 12,5 mL. Tính thành phần % theo khối lượng của FeCO3 trong quặng.
Lời giải:
Đang cập nhật...
Bài tiếp theo: Giải Hóa 12 Chân trời sáng tạo bài 20









