Giải Hóa 12 Chân trời sáng tạo bài 15
Giải Hóa 12 Chân trời sáng tạo bài 15: Các phương pháp tách kim loại
Giải Hóa 12 Chân trời sáng tạo bài 15: Các phương pháp tách kim loại được VnDoc.com tổng hợp với hướng dẫn trả lời chi tiết các câu hỏi trong SGK Hóa học 12 Chân trời sáng tạo các trang 81, 82, 83, 84.
Giải Hóa 12 trang 81 Chân trời
Mở đầu trang 81 SGK Hóa học 12
Sau khi khai thác quặng, cần thực hiện quá trình tách kim loại để thu được kim loại tinh khiết. Có những phương pháp nào để tách kim loại?
Lời giải:
Một số phương pháp tách kim loại:
+ Phương pháp nhiệt luyện.
+ Phương pháp thuỷ luyện.
+ Phương pháp điện phân.
Thảo luận 1 trang 81 SGK Hóa học 12
Tìm hiểu và nêu trạng thái tự nhiên của một số kim loại.
Lời giải:
Trong tự nhiên, chỉ có một số ít kim loại tồn tại ở dạng đơn chất (như vàng, bạc, platinum …), hầu hết các kim loại tồn tại ở dạng hợp chất trong các quặng, mỏ.
Giải Hóa 12 trang 82 Chân trời
Thảo luận 2 trang 82 SGK Hóa học 12
Xác định chất oxi hoá, chất khử trong các phản ứng ở Ví dụ 1.
Ví dụ 1:
ZnO + C ![]() \(\overset{t^{0} }{\rightarrow}\) Zn + CO
\(\overset{t^{0} }{\rightarrow}\) Zn + CO
Fe2O3 + 3CO ![]() \(\overset{t^{0} }{\rightarrow}\) 2Fe + 3CO2
\(\overset{t^{0} }{\rightarrow}\) 2Fe + 3CO2
Lời giải:
- Xét phản ứng:
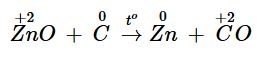
Số oxi hoá của C tăng từ 0 lên +2 nên C đóng vai trò là chất khử; số oxi hoá của Zn giảm từ +2 xuống 0 nên ZnO đóng vai trò là chất oxi hoá.
- Xét phản ứng:
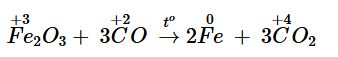
Số oxi hoá của C tăng từ +2 lên +4 nên CO đóng vai trò là chất khử; số oxi hoá của Fe giảm từ +3 xuống 0 nên Fe2O3 đóng vai trò là chất oxi hoá.
Luyện tập trang 82 SGK Hóa học 12
Trình bày cách tách Cu từ Cu(OH)2 bằng phương pháp nhiệt luyện. Viết phương trình hoá học của các phản ứng xảy ra.
Lời giải:
Bước 1: Nhiệt phân Cu(OH)2 thu được CuO:
Cu(OH)2 ![]() \(\overset{t^{0} }{\rightarrow}\) CuO + H2O
\(\overset{t^{0} }{\rightarrow}\) CuO + H2O
Bước 2: Dùng CO hoặc C khử CuO thu được kim loại Cu:
CO + CuO ![]() \(\overset{t^{0} }{\rightarrow}\) Cu + CO2
\(\overset{t^{0} }{\rightarrow}\) Cu + CO2
Hoặc C + 2CuO → 2Cu + CO2
Giải Hóa 12 trang 83 Chân trời
Thảo luận 3 trang 83 SGK Hóa học 12
Hãy so sánh phương pháp nhiệt luyện và phương pháp thuỷ luyện. Phương pháp nào thường dùng trong phòng thí nghiệm để tách kim loại? Giải thích.
Lời giải:
|
|
Phương pháp thuỷ luyện |
Phương pháp nhiệt luyện |
|
Giống nhau |
- Đều dùng để tách kim loại và đều thực hiện bằng cách khử những ion của kim loại hoạt động yếu. |
|
|
Khác nhau |
Hoà tan kim loại hoặc hợp chất của những kim loại hoạt động yếu trong dung dịch thích hợp để tách ra khỏi phần không tan có trong quặng. Sau đó, các ion kim loại được khử bằng kim loại hoạt động mạnh hơn. |
Khử những ion của kim loại hoạt động yếu và trung bình trong các oxide của chúng ở nhiệt độ cao bằng chất khử C, CO,… |
Phương pháp thường dùng trong phòng thí nghiệm để tách kim loại là phương pháp thuỷ luyện do phương pháp này dễ thực hiện trong phòng thí nghiệm.
Thảo luận 4 trang 83 SGK Hóa học 12
Có thể điện phân dung dịch muối của bạc để tách kim loại này được không? Viết phương trình hoá học của phản ứng xảy ra (nếu có).
Lời giải:
Bạc là kim loại có mức độ hoạt động yếu nên có thể dùng phương pháp điện phân dung dịch muối của bạc để tách kim loại này.
Ví dụ điện phân dung dịch AgNO3:
Tại anode (cực dương): 2H2O → O2 + 4H+ + 4e
Tại cathode (cực âm): Ag+ + 1e→Ag
Phương trình hoá học của phản ứng điện phân:
4AgNO3 + 2H2O ![]() \(\overset{đpdd}{\rightarrow}\) 4Ag + O2 + 4HNO3
\(\overset{đpdd}{\rightarrow}\) 4Ag + O2 + 4HNO3
Giải Hóa 12 trang 84 Chân trời
Thảo luận 5 trang 84 SGK Hóa học 12
Tìm hiểu về một số làng nghề tái chế kim loại phổ biến Al, Fe, Cu ở Việt Nam. Nêu thực trạng về môi trường tại làng nghề đó.
Lời giải:
Ở Việt Nam, tái chế kim loại ở các làng nghề đa phần là tái chế kim loại thủ công. Tái chế kim loại thủ công được hiểu là chế tạo theo quy trình đơn giản bằng các công cụ thô sơ tại hộ gia đình hay các cơ sở sản xuất nhỏ. Vì vậy, người sản xuất thường không có đủ điều kiện đầu tư đồng bộ để đảm bảo hiệu quả, chất lượng và an toàn. Từ đó, hoạt động tái chế kim loại thủ công thường tác động tiêu cực đến môi trường và con người.
Bài tập 1 trang 84 SGK Hóa học 12
Viết sơ đồ tách kim loại bằng một phương pháp hoá học thích hợp từ mỗi nguyên liệu MgO và Fe2O3. Viết phương trình hoá học của các phản ứng xảy ra (nếu có).
Lời giải:
- Tách Mg từ MgO bằng phương pháp điện phân nóng chảy: MgO ![]() \(\overset{đpnc}{\rightarrow}\)Mg.
\(\overset{đpnc}{\rightarrow}\)Mg.
Phương trình hoá học:
2MgO ![]() \(\overset{đpnc}{\rightarrow}\) 2Mg + O2
\(\overset{đpnc}{\rightarrow}\) 2Mg + O2
- Tách Fe từ Fe2O3 bằng phương pháp nhiệt luyện: Fe2O3 ![]() \(\overset{+C/CO}{\rightarrow}\) Fe.
\(\overset{+C/CO}{\rightarrow}\) Fe.
Phương trình hoá học:
Fe2O3 + 3CO ![]() \(\overset{t^{0} }{\rightarrow}\) 2Fe + 3CO2
\(\overset{t^{0} }{\rightarrow}\) 2Fe + 3CO2
Hoặc Fe2O3 + 3C ![]() \(\overset{t^{0} }{\rightarrow}\) 2Fe + 3CO
\(\overset{t^{0} }{\rightarrow}\) 2Fe + 3CO
Bài tập 2 trang 84 SGK Hóa học 12
Trình bày phương pháp hoá học thích hợp để tách kim loại bạc ra khỏi hỗn hợp kim loại bạc và đồng. Viết phương trình hoá học của các phản ứng.
Lời giải:
Cho hỗn hợp kim loại gồm bạc và đồng qua lượng dư dung dịch muối sắt(III) như Fe(NO3)3. Khi đó, đồng (Cu) phản ứng tạo thành muối tan; còn bạc (Ag) không phản ứng.
Lọc thu lấy kim loại, rửa sạch để thu được kim loại bạc tinh khiết.
Phương trình hoá học minh hoạ:
Cu + 2Fe(NO3)3 → Cu(NO3)2 + 2Fe(NO3)2
Ag + Fe(NO3)3 → không phản ứng.
Bài tập 3 trang 84 SGK Hóa học 12
Đá vôi là loại đá trầm tích bao gồm các khoáng vật calcite và các dạng kết tinh khác nhau của calcium carbonate. Đá vôi (thành phần chính CaCO3) có nhiều ứng dụng trong đời sống và sản xuất. Hãy lựa chọn và trình bày phương pháp hoá học thích hợp điều chế calcium từ CaCO3. Viết phương trình hoá học của các phản ứng.
Lời giải:
Đang cập nhật...
Bài tiếp theo: Giải Hóa 12 Chân trời sáng tạo bài 16









