Giải Hóa 12 Chân trời sáng tạo bài 13
Giải Hóa 12 Chân trời sáng tạo bài 13: Điện phân
Giải Hóa 12 Chân trời sáng tạo bài 13: Điện phân được VnDoc.com sưu tầm và xin gửi tới bạn đọc cùng tham khảo. Bài viết hướng dẫn trả lời chi tiết các câu hỏi trong SGK Hóa học 12 Chân trời sáng tạo các trang 70, 71, 72, 73, 74.
Giải Hóa 12 trang 70 Chân trời
Mở đầu trang 70 SGK Hóa 12
Pin điện hoá hoạt động dựa trên các phản ứng oxi hoá – khử tự xảy ra trong pin (hoá năng chuyển thành điện năng). Tuy nhiên, một số phản ứng oxi hoá – khử chỉ có thể xảy ra nhờ năng lượng dòng điện, được gọi là phản ứng điện phân (điện năng chuyển thành hoá năng).
Khi điện phân, các quá trình trên bề mặt điện cực xảy ra theo nguyên tắc nào? Điện phân có ứng dụng gì trong đời sống, sản xuất?
Lời giải:
* Nguyên tắc điện phân nóng chảy:
- Tại cathode (điện cực âm): xảy ra quá trình khử ion dương.
- Tại anode (điện cực dương): xảy ra quá trình oxi hoá ion âm.
* Nguyên tắc điện phân dung dịch: ở cathode, ưu tiên điện phân chất có tính oxi hoá mạnh hơn; ở anode, ưu tiên điện phân chất có tính khử mạnh hơn.
* Phương pháp điện phân có nhiều ứng dụng trong thực tiễn, đặc biệt là điều chế, tinh chế một số kim loại, mạ điện …
Thảo luận 1 trang 70 SGK Hóa 12
Xác định sản phẩm tạo thành ở hai điện cực khi điện phân NaCl nóng chảy.
Lời giải:
Quá trình xảy ra ở mỗi điện cực:
Cực dương (anode): 2Cl− → Cl2 + 2e
Cực âm (cathode): Na+ + 1e → Na
Như vậy, khi điện phân NaCl nóng chảy ở cực dương thu được khí Cl2 và ở cực âm thu được kim loại Na.
Luyện tập trang 70 SGK Hóa 12
Viết phương trình hoá học của quá trình điện phân nóng chảy các chất: MgCl2, Al2O3.
Lời giải:
Phương trình hoá học:
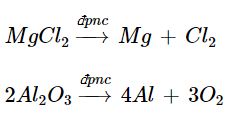
Giải Hóa 12 trang 71 Chân trời
Thảo luận 2 trang 71 SGK Hóa 12
Tiến hành Thí nghiệm 1 và nêu hiện tượng quan sát được.
Lời giải:
|
Thí nghiệm 1 Điện phân dung dịch CuSO4, điện cực graphite (than chì) |
Hiện tượng |
Giải thích |
|
Bước 1: Rót dung dịch CuSO4 0,5 M vào cốc thuỷ tinh. Bước 2: Cắm hai điện cực vào cốc, nối điện cực với nguồn điện một chiều. Bước 3: Điều chỉnh nguồn điện khoảng 3 V – 6 V và duy trì quá trình điện phân trong khoảng 5 phút.
|
Ở cực dương (anode) có khí thoát ra; ở cực âm (cathode) có lớp kim loại màu đỏ bám trên cathode. Dung dịch trong cốc nhạt màu dần. |
+ Ở anode có thể xảy ra sự oxi hoá ion sulfate hoặc phân tử H2O. Tuy nhiên, vì H2O dễ bị oxi hoá hơn ion sulfate nên H2O bị oxi hoá trước, tạo thành sản phẩm là khí O2. 2H2O → O2 + 4H+ + 4 e + Ở cathode có thể xảy ra sự khử ion Cu2+ hoặc phân tử H2O. Vì ion Cu2+ dễ bị khử hơn H2O nên ion Cu2+ bị khử trước, tạo thành ion kim loại Cu bám trên cathode. Cu2+ + 2e → Cu (Lưu ý: ion sulfate |
Thảo luận 3 trang 71 SGK Hóa 12
Cho biết khi điện phân dung dịch CuSO4, ion Cu2+ và ![]() \(SO_{4}^{2-}\) di chuyển về điện cực nào.
\(SO_{4}^{2-}\) di chuyển về điện cực nào.
Lời giải:
Trong thí nghiệm điện phân dung dịch CuSO4, khi có dòng điện chạy qua dung dịch, ion sulfate ![]() \(SO_{4}^{2-}\) di chuyển về phía anode, ion Cu2+ di chuyển về phía cathode.
\(SO_{4}^{2-}\) di chuyển về phía anode, ion Cu2+ di chuyển về phía cathode.
Thảo luận 4 trang 71 SGK Hóa 12
Xác định sản phẩm sinh ra ở điện cực khi điện phân dung dịch CuSO4 với điện cực trơ.
Lời giải:
Ta có sơ đồ điện phân:
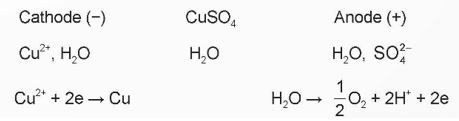
Vậy sản phẩm thu được ở điện cực âm (cathode) là kim loại Cu; sản phẩm thu được ở điện cực dương (anode) là khí O2 và acid H2SO4.
Giải Hóa 12 trang 72 Chân trời
Thảo luận 5 trang 72 SGK Hóa 12
Tiến hành Thí nghiệm 2 và nêu hiện tượng xảy ra. Giải thích.
Lời giải:
|
Thí nghiệm 2 Điều chế nước Javel |
Hiện tượng |
Giải thích |
|
Bước 1: Lấy 500 mL nước cất vào cốc thuỷ tinh. Sau đó cho khoảng 150 gam muối ăn và khuấy đều đến khi tan hết. Bước 2: Cắm hai điện cực vào cốc thuỷ tinh. Nối dây dẫn vào nguồn điện một chiều và duy trì điện phân trong 5 phút. |
Ở hai điện cực đều có khí thoát ra.
|
Quá trình oxi hoá, quá trình khử xảy ra ở mỗi điện cực: Tại anode: 2Cl− → Cl2 + 2e Tại cathode: 2H2O + 2e → 2OH− + H2 |
Luyện tập trang 72 SGK Hóa 12
Viết quá trình xảy ra ở mỗi điện cực và phương trình hoá học của phản ứng điện phân khi điện phân dung dịch AgNO3; CuCl2 với điện cực graphite.
Lời giải:
* Điện phân dung dịch AgNO3:
Tại anode (cực dương): 2H2O → O2 + 4H+ + 4e
Tại cathode (cực âm): Ag+ + 1e → Ag
Phương trình hoá học của phản ứng điện phân:
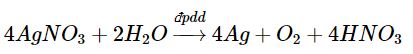
* Điện phân dung dịch CuCl2:
Tại anode (cực dương): 2Cl− → Cl2 + 2e
Tại cathode (cực âm): Cu2+ + 2e → Cu
Phương trình hoá học của phản ứng điện phân:
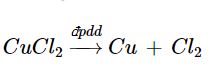
Giải Hóa 12 trang 73 Chân trời
Thảo luận 6 trang 73 SGK Hóa 12
Em hãy tìm hiểu và nêu một số ứng dụng của phương pháp điện phân trong thực tiễn.
Lời giải:
Điện phân có nhiều ứng dụng quan trọng trong thực tiễn như: sản xuất kim loại mạnh, mạ điện, tinh chế kim loại …
Ví dụ tinh luyện đồng bằng phương pháp điện phân: Đồng có độ tinh khiết cao có khả năng dẫn điện tốt, bền về mặt hoá học nên được sử dụng rộng rãi trong các thiết bị điện tử. Đồng có độ tinh khiết cao có thể thu được từ đồng có độ tinh khiết thấp qua quá trình tỉnh luyện bằng phương pháp điện phân, trong đó:
- Dung dịch chất điện li là dung dịch CuSO4.
- Cực dương làm bằng tấm đồng có độ tinh khiết thấp.
- Cực âm làm bằng tấm đồng có độ tinh khiết cao.
Khi dòng diện chạy qua dung dịch, các ion đồng bị diện phân bám lên cực âm tạo lớp đồng tinh khiết. Đồng trong cực dương bị tan ra, các tạp chất lắng xuống đáy bể dưới dạng "bùn dương cực".
Giải Hóa 12 trang 74 Chân trời
Bài tập 1 trang 74 SGK Hóa 12
Điện phân CaCl2 nóng chảy, ở cathode xảy ra quá trình nào?
A. Oxi hoá ion Ca2+.
B. Khử ion Ca2+.
C. Oxi hoá ion Cl−.
D. Khử ion Cl−.
Lời giải:
Đáp án đúng là: B
Bài tập 2 trang 74 SGK Hóa 12
Điện phân dung dịch Cu(NO3)2 với điện cực trơ, ở anode xảy ra quá trình nào?
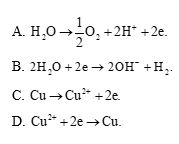
Lời giải:
Đáp án đúng là: A
Bài tập 3 trang 74 SGK Hóa 12
Viết phương trình hoá học của phản ứng điện phân khi điện phân KCl nóng chảy.
Lời giải:
Đang cập nhật...
Bài tập 4 trang 74 SGK Hóa 12
Hãy đề xuất và trình bày cách mạ đồng (Cu) lên một đồ vật làm từ sắt (Fe) bằng phương pháp điện phân.
Lời giải:
Đang cập nhật...
Bài tiếp theo: Giải Hóa 12 Chân trời sáng tạo bài 14










