Giải Hóa 12 Chân trời sáng tạo bài 6
Giải Hóa 12 Chân trời sáng tạo bài 6: Amine
VnDoc.com xin gửi tới bạn đọc bài viết Giải Hóa 12 Chân trời sáng tạo bài 6: Amine để bạn đọc cùng tham khảo. Bài viết hướng dẫn trả lời chi tiết các câu hỏi trong SGK Hóa học 12 Chân trời sáng tạo các trang 30, 31, 32 ... 38.
Giải Hóa 12 trang 30 Chân trời
Mở đầu trang 30 SGK Hóa 12
Histamine là một amine tự nhiên được tìm thấy trong cơ thể người và nhiều loại động vật. Histamine tồn tại một trong hai dạng, dạng dự trữ ở khắp các mô trong cơ thể hoặc dạng tự do. Một trong những tác động của histamine là gây viêm, dị ứng. Khi cơ thể gặp tình huống gây kích thích (dị ứng thời tiết, thực phẩm, hoá chất, ...), histamine chuyển thành dạng tự do, gây ra các triệu chứng sưng, đỏ, ngứa. Điều này giúp cơ thể chống lại các tác nhân gây hại bằng cách kích thích hệ thống miễn dịch của cơ thể.
Amine là gì? Amine có những tính chất và ứng dụng nào trong thực tiễn?
Lời giải:
- Amine là dẫn xuất của ammonia, trong đó nguyên tử hydrogen trong phân tử ammonia được thay thế bằng gốc hydrocarbon.
- Tính chất vật lí của amine: Ở điều kiện thường, amine có thể tồn tại ở thể khí, lỏng hoặc rắn. Nhiệt độ nóng chảy, nhiệt độ sôi của các amine cùng bậc có xu hướng tăng khi phân tử khối tăng. Các amine có số nguyên tử carbon nhỏ thường tan nhiều trong nước.
- Tính chất hoá học của amine: Amine có tính base và phản ứng tạo phức; phản ứng với nitrous acid; ngoài ra, aniline phản ứng được với nước bromine.
- Ứng dụng của amine: Amine được ứng dụng trong nhiều lĩnh vực công nghiệp, nông nghiệp, dược phẩm, thuốc nhuộm và sản xuất vật liệu.
Giải Hóa 12 trang 31 Chân trời
Thảo luận 1 trang 31 SGK Hóa 12
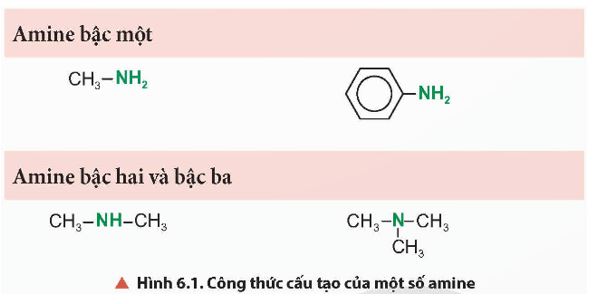
Quan sát Hình 6.1, cho biết nhóm chức đặc trưng nào có trong phân tử amine.
Lời giải:
Nhóm chức đặc trưng trong phân tử amine là nhóm chức amine (−NH2 hoặc −NH− hoặc > N −)
Thảo luận 2 trang 31 SGK Hóa 12
Dựa vào số nguyên tử hydrogen của phân tử NH3 bị thay thế và đặc điểm cấu tạo của nhóm thế, cho biết amine được phân loại như thế nào. Thế nào là amine bậc một, amine bậc hai và amine bậc ba?
Lời giải:
- Dựa vào số nguyên tử hydrogen của phân tử NH3 bị thay thế amine được phân loại thành: amine bậc một, amine bậc hai và amine bậc ba.
- Dựa vào đặc điểm cấu tạo của nhóm thế amine được phân thành nhiều loại trong đó điển hình là: alkylamine (nhóm amine liên kết với gốc alkyl) và arylamine (nhóm amine liên kết trực tiếp với nguyên tử carbon của vòng benzene).
- Bậc của amine được tính bằng số gốc hydrocarbon liên kết trực tiếp với nguyên tử nitrogen.
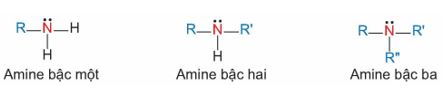
+ Amine bậc một: có 1 gốc hydrocarbon liên kết trực tiếp với nguyên tử nitrogen.
+ Amine bậc hai: có 2 gốc hydrocarbon liên kết trực tiếp với nguyên tử nitrogen.
+ Amine bậc ba: có 3 gốc hydrocarbon liên kết trực tiếp với nguyên tử nitrogen.
Luyện tập trang 31 SGK Hóa 12
Cho 2 chất sau: CH3 – CH2 – NH2 và CH3 – COONH4. Chất nào thuộc loại amine? Xác định bậc của amine đó.
Lời giải:
- Amine là dẫn xuất của ammonia, trong đó nguyên tử hydrogen trong phân tử ammonia được thay thế bằng gốc hydrocarbon. Vậy chất thuộc loại amine là: CH3 – CH2 – NH2.
- Đây là amine bậc I do có 1 gốc hydrocarbon liên kết trực tiếp với nguyên tử nitrogen.
Giải Hóa 12 trang 32 Chân trời
Thảo luận 3 trang 32 SGK Hóa 12
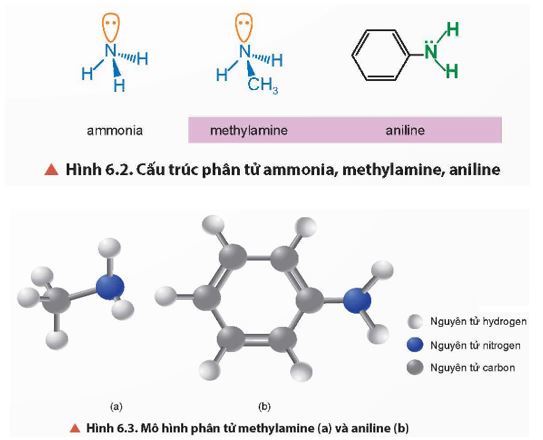
Quan sát Hình 6.2 và Hình 6.3, cho biết hình dạng phân tử của methylamine và aniline.
Lời giải:
Tương tự như ammonia, nguyên tử nitrogen trong phân tử methylamine và aniline tạo 3 liên kết cộng hoá trị với hydrogen hoặc gốc hydrocarbon và có một cặp electron chưa liên kết.
Thảo luận 4 trang 32 SGK Hóa 12
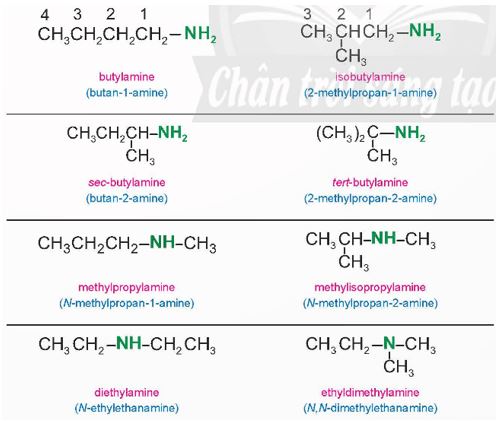
Nghiên cứu Ví dụ 1, cho biết amine có loại đồng phân nào. Phân tích cách gọi tên amine theo 2 loại danh pháp đã nêu
Ví dụ 1: Amine ứng với công thức phân tử C4H11N có các công thức cấu tạo, tên gốc – chức (màu hồng) và tên thay thế (màu xanh dương) như sau:
Lời giải:
- Amine có đồng phân mạch carbon, đồng phân vị trí nhóm chức và đồng phân bậc amine.
- Amine đơn chức được gọi tên như sau:
+ Theo danh pháp gốc – chức: Tên gốc Hydrocarbon + amine
Amine bậc hai: Chọn mạch carbon dài nhất chứa nguyên tử nitrogen làm mạch chính: N-tên gốc Hydrocarbon + tên Hydrocarbon mạch chính (bỏ kí tự e) + số chỉ vị trí nhóm amine + amine
Amine bậc ba: Chọn mạch carbon dài nhất chứa nguyên tử nitrogen làm mạch chính.

Giải Hóa 12 trang 33 Chân trời
Luyện tập trang 33 SGK Hóa 12
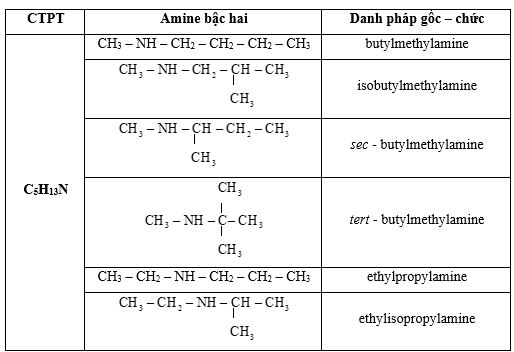
Viết công thức cấu tạo và gọi tên theo danh pháp gốc – chức các amine bậc hai có công thức phân tử C5H13N.
Lời giải:
Thảo luận 5 trang 33 SGK Hóa 12
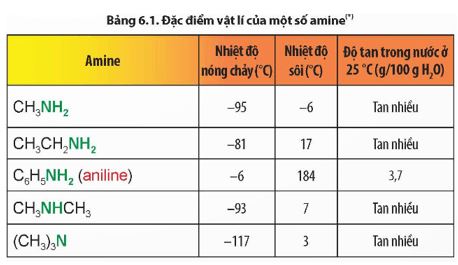
Quan sát Bảng 6.1, kể tên các amine thể khí ở điều kiện thường. Nhận xét xu hướng biến đổi nhiệt độ nóng chảy, nhiệt độ sôi và khả năng hoà tan trong nước của các amine.
Lời giải:
- Ở điều kiện thường methylamine, ethylamine, dimethylamine, trimethylamine tồn tại ở thể khí.
- Nhiệt độ nóng chảy, nhiệt độ sôi của các amine có xu hướng tăng khi phân tử khối tăng.
- Khả năng hoà tan trong nước của các amine có xu hướng giảm khi phân tử khối tăng.
Giải Hóa 12 trang 34 Chân trời
Thảo luận 6 trang 34 SGK Hóa 12
Cho biết liên kết hydrogen ảnh hưởng như thế nào đến nhiệt độ nóng chảy, nhiệt độ sôi, độ tan trong nước của amine.
Lời giải:
- Giữa các phân tử amine bậc một hoặc amine bậc hai có liên kết hydrogen liên phân tử, nên nhiệt độ nóng chảy, nhiệt độ sôi của chúng cao hơn so với những amine hoặc hydrocarbon … có phân tử khối tương đương mà không có liên kết hydrogen.
- Các amine có thể hình thành liên kết hydrogen với nước thì tan tốt trong nước.
Thảo luận 7 trang 34 SGK Hóa 12
Tiến hành Thí nghiệm 1, quan sát và nêu hiện tượng thí nghiệm. Dựa vào phương trình hoá học của các phản ứng (nếu có), giải thích kết quả thí nghiệm.
Lời giải:
|
Thí nghiệm 1 |
Hiện tượng thí nghiệm |
Phương trình hoá học, giải thích |
|
Đĩa thuỷ tinh Bước 1: Đặt vào mẩu giấy quỳ tím. Bước 2: Nhỏ vài giọt dung dịch CH3NH2 vào mẩu giấy quỳ tím. |
Giấy quỳ tím chuyển sang màu xanh |
Trong dung dịch, CH3NH2 phản ứng với nước tạo ra ion hydroxide làm quỳ tím chuyển sang màu xanh. CH3NH2 + H2O ⇌ CH3NH3+ + OH− |
|
Ống nghiệm 1 - Bước 1: Lấy 2 mL dung dịch CH3NH2 và nhỏ thêm vài giọt dung dịch phenolphthalein. - Bước 2: Nhỏ từ từ dung dịch HCl vào, lắc đều. |
- Sau bước 1 dung dịch thu được có màu hồng. - Ở bước 2, nhỏ từ từ HCl vào, dung dịch chuyển dần từ màu hồng sang mất màu. |
- Trong dung dịch, CH3NH2 phản ứng với nước tạo ra ion hydroxide làm dung dịch phenolphthalein không màu chuyển sang màu hồng. CH3NH2 + H2O ⇌ CH3NH3+ + OH− - Methylamine phản ứng vừa đủ với HCl tạo thành muối CH3NH3Cl có môi trường acid không làm đổi màu phenolphthalein. CH3NH2 + HCl → CH3NH3Cl |
|
Ống nghiệm 2 - Bước 1: Lấy khoảng 1 mL dung dịch FeCl3. - Bước 2: Nhỏ từ từ khoảng 3mL dung dịch CH3NH2 vào, lắc đều. |
Xuất hiện kết tủa màu nâu đỏ. |
CH3NH2 phản ứng với FeCl3 trong dung dịch tạo thành Fe(OH)3 là chất kết tủa màu nâu đỏ. FeCl3 + 3CH3NH2 + 3H2O → Fe(OH)3↓ + 3CH3NH3Cl |
Luyện tập trang 34 SGK Hóa 12
Viết phương trình hoá học thể hiện tính base của aniline qua phản ứng với dung dịch HCl.
Lời giải:
Phương trình hoá học: C6H5NH2 + HCl → C6H5NH3Cl
Giải Hóa 12 trang 35 Chân trời
Thảo luận 8 trang 35 SGK Hóa 12
Từ Ví dụ 2 và Ví dụ 3, xác định bậc của amine trong 2 phản ứng với nitrous acid. Cho biết sự khác nhau về 2 loại sản phẩm hữu cơ.
Ví dụ 2: Ethylamine phản ứng với HNO2 sinh ra nitrogen và ethanol.
CH3CH2NH2 + HNO2 → CH3CH2OH + N2↑ + H2O
Ví dụ 3: Aniline phản ứng với HNO2 ở nhiệt độ thấp (0 – 5 oC) sinh ra muối diazonium.

Lời giải:
|
|
Bậc của amine |
Sản phẩm hữu cơ |
|
Ví dụ 1 |
Bậc một |
Nitrogen, alcohol, nước |
|
Ví dụ 2 |
Bậc một |
Muối diazonium, nước |
Thảo luận 9 trang 35 SGK Hóa 12
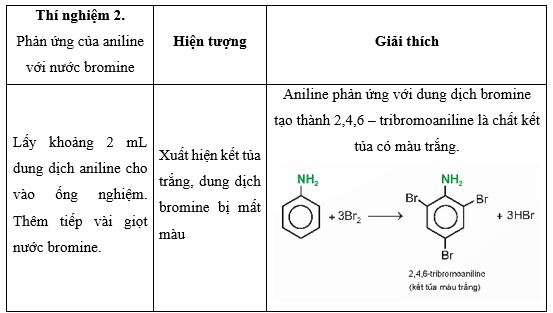
Tiến hành Thí nghiệm 2, nêu hiện tượng và giải thích kết quả thí nghiệm.
Lời giải:
Giải Hóa 12 trang 36 Chân trời
Luyện tập trang 36 SGK Hóa 12
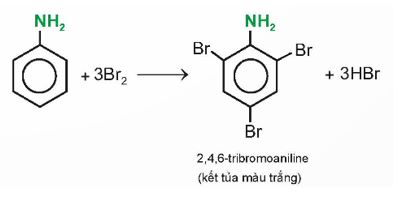
Có thể phân biệt aniline với benzene bằng phản ứng với nước bromine không? Giải thích.
Lời giải:
Có thể phân biệt aniline với benzene bằng phản ứng với nước bromine. Do:
+ Benzene không phản ứng với nước bromine ở điều kiện thường.
+ Aniline phản ứng với nước bromine ở điều kiện thường, sinh ra kết tủa trắng.
Thảo luận 10 trang 36 SGK Hóa 12
Tiến hành Thí nghiệm 3, nêu hiện tượng và giải thích kết quả thí nghiệm.
Lời giải:
|
Thí nghiệm 3: Methylamine phản ứng tạo phức với Cu(OH)2 |
Hiện tượng |
Giải thích kết quả thí nghiệm |
|
Bước 1: Lấy khoảng 0,5 mL dung dịch CuSO4 vào ống nghiệm. Bước 2: Thêm tiếp từ từ khoảng 4 mL dung dịch CH3NH2, lắc đều ống nghiệm. |
Ban đầu thu được kết tủa xanh. Sau đó kết tủa tan dần, tạo dung dịch có màu xanh lam. |
Methylamine phản ứng với CuSO4 tạo thành kết tủa xanh là Cu(OH)2. CuSO4 + 2CH3NH2 + 2H2O → Cu(OH)2↓ + (CH3NH3)2SO4 Sau đó, methylamine tiếp tục tác dụng với Cu(OH)2 tạo dung dịch phức chất có màu xanh lam. Cu(OH)2 + 4CH3NH2 → [Cu(CH3NH2)4](OH)2 |
Luyện tập trang 36 SGK Hóa 12
Viết phương trình hoá học của phản ứng tạo phức khi cho ethylamine tác dụng với Cu(OH)2.
Lời giải:
Phương trình hoá học: Cu(OH)2 + 4CH3CH2NH2 → [Cu(CH3CH2NH2)4](OH)2
Giải Hóa 12 trang 37 Chân trời
Thảo luận 11 trang 37 SGK Hóa 12
Từ thông tin về ứng dụng của amine, cho biết vai trò của amine trong đời sống, sản xuất, y học.
Lời giải:
Amine có vai trò quan trọng trong đời sống, sản xuất, y học. Cụ thể:
+ Amine được ứng dụng trong nhiều lĩnh vực như tổng hợp polyamide, dược phẩm, hoá chất dùng trong nông nghiệp và các vật liệu khác.
+ Aniline thường được sử dụng để sản xuất phẩm nhuộm, dược phẩm…
Thảo luận 12 trang 37 SGK Hóa 12
Nêu phương pháp phổ biến điều chế amine.
Lời giải:
Phương pháp phổ biến để điều chế amine: khử hợp chất nitro hoặc alkyl hoá ammonia.
+ Khử hợp chất nitro: Hợp chất có nhóm nitro có thể bị khử thành nhóm amine bởi một số kim loại như Fe, Zn, … trong môi trường acid.
+ Alkyl hoá ammonia: Dẫn xuất halogen phản ứng với ammonia có thể tạo ra các sản phẩm là amine bậc một, bậc hai, bậc ba.
Vận dụng trang 37 SGK Hóa 12
Khói thuốc lá và thuốc lá điện tử chứa các thành phần nicotine, carbon monoxide, benzene, formaldehyde, acetaldehyde, hydrogen cyanide, ... là những chất tác động trực tiếp lên não, thần kinh, tim mạch, hệ hô hấp và nguy cơ dẫn đến ung thư. Một số bạn trẻ cho rằng hút thuốc là “sành điệu”, thuốc lá điện tử không gây hại, . . . Hãy nêu quan điểm của em.
Lời giải:
Quan điểm của em:
Khói thuốc lá và thuốc lá điện tử chứa các thành phần nicotine, carbon monoxide, benzene, formaldehyde, acetaldehyde, hydrogen cyanide, ... là những chất tác động trực tiếp lên não, thần kinh, tim mạch, hệ hô hấp và nguy cơ dẫn đến ung thư. Do đó cả thuốc lá và thuốc lá điện tử đều gây hại.
Vậy, hút thuốc lá không phải là “sành điệu” mà là đang tự huỷ hoại chính mình. Không nên vì phút chốc “sĩ diện” mà đánh đổi sức khoẻ của bạn thân, hãy tránh xa thuốc lá để bảo vệ chính bản thân mình và mọi người xung quanh.
Giải Hóa 12 trang 38 Chân trời
Bài tập 1 trang 38 SGK Hóa 12
Tên gọi và bậc của amine có công thức cấu tạo CH3CH2CH(CH3)CH2-NH2 là
A. 3-methylbutan-4-amine, bậc một.
B. 2-methylbutan-1-anine, bậc hai.
C. 3-methylbutan-4-amine, bậc hai.
D. 2-methylbutan-1-amine, bậc một.
Lời giải:
Đáp án đúng là: D
Bài tập 2 trang 38 SGK Hóa 12
Số đồng phân amine bậc ba có công thức phân tử C5H13N là
A. 2.
B. 3.
C. 4.
D. 5.
Lời giải:
Đáp án đúng là: B
Bài tập 3 trang 38 SGK Hóa 12
Mùi tanh của cá chủ yếu do amine gây ra như trimethylamine. Làm thế nào để khử mùi tanh của cá?
Lời giải:
Đang cập nhật...
Bài tập 4 trang 38 SGK Hóa 12
Ephedrine được sử dụng với hàm lượng nhất định trong các loại thuốc điều trị cảm và dị ứng. Ephedrine có mùi tanh và dễ bị oxi hoá trong không khí, do đó người ta thưởng hạn chế sử dụng trực tiếp. Ephedrine hydrochloride khó bị oxi hoá, không mùi và vẫn giữ được hoạt tính của hợp chất. Ephedrine hydrochloride được điều chế từ phản ứng của ephedrine với hydrochloric acid. Viết phương trình hoá học của phản ứng xảy ra.
Lời giải:
Đang cập nhật...
Bài tiếp theo: Giải Hóa 12 Chân trời sáng tạo bài 7










