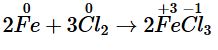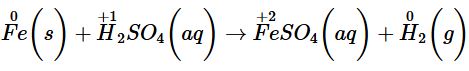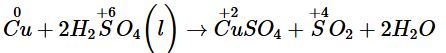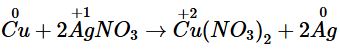Giải Hóa 12 Chân trời sáng tạo bài 14
Giải Hóa 12 Chân trời sáng tạo bài 14: Đặc điểm cấu tạo và liên kết kin loại. Tính chất kim loại
VnDoc.com xin gửi tới bạn đọc bài viết Giải Hóa 12 Chân trời sáng tạo bài 14: Đặc điểm cấu tạo và liên kết kin loại. Tính chất kim loại để bạn đọc cùng tham khảo. Bài viết hướng dẫn trả lời chi tiết các câu hỏi trong SGK Hóa học 12 Chân trời sáng tạo các trang 75, 76, 77, 78, 79, 80.
Giải Hóa 12 trang 75 Chân trời
Mở đầu trang 75 SGK Hóa học 12
Kim loại giữ vai trò quan trọng trong các ngành kĩ thuật vì chúng có những tính chất vật lí, hoá học đặc biệt. Kim loại có cấu tạo nguyên tử như thế nào? Có những tính chất và ứng dụng gì?
Lời giải:
- Đặc điểm cấu tạo nguyên tử kim loại: đa số các nguyên tử kim loại có số electron lớp ngoài cùng là 1, 2, 3.
- Kim loại có những tính chất vật lí chung: tính ánh kim, tính dẫn điện, tính dẫn nhiệt và tính dẻo.
- Tính chất hoá học của kim loại: hầu hết các kim loại có thể phản ứng với phi kim, với dung dịch acid; một số kim loại có thể phản ứng được với nước, với dung dịch muối.
Thảo luận 1 trang 75 SGK Hóa học 12
Hãy nêu nhận xét về số electron lớp ngoài cùng của các nguyên tử kim loại Na, Mg, Al, Fe, Cu, Zn.
Lời giải:
|
Nguyên tử |
Na |
Mg |
Al |
Fe |
Cu |
Zn |
|
Số electron lớp ngoài cùng |
1 |
2 |
3 |
2 |
2 |
2 |
Nhận xét: Các nguyên tử kim loại như Na, Mg, Al, Fe, Cu, Zn có số electron lớp ngoài cùng là 1, 2 hoặc 3.
Giải Hóa 12 trang 76 Chân trời
Thảo luận 2 trang 76 SGK Hóa học 12
So sánh liên kết kim loại với liên kết ion và liên kết cộng hoá trị.
Lời giải:
|
Liên kết kim loại |
Liên kết ion |
Liên kết cộng hoá trị |
|
Liên kết kim loại được hình thành do lực hút tĩnh điện giữa các electron hoá trị chuyển động tự do với các ion dương kim loại trong mạng tinh thể kim loại. |
Liên kết ion được hình thành bởi lực hút tĩnh điện giữa các ion mang điện tích trái dấu. |
Liên kết cộng hoá trị là liên kết được hình thành bởi một hay nhiều cặp electron dùng chung giữa hai nguyên tử. |
Giải Hóa 12 trang 77 Chân trời
Thảo luận 3 trang 77 SGK Hóa học 12
Vàng được sử dụng làm đồ trang sức nhờ tính chất vật lí nào của kim loại?
Lời giải:
Nhờ có tính ánh kim mà vàng được dùng để làm đồ trang sức. Ngoài ra, nhờ tính dẻo mà vàng có thể được kéo sợi, dát mỏng … tạo thành những đồ trang sức có những hình dạng và mẫu mã đẹp như ý muốn.
Thảo luận 4 trang 77 SGK Hóa học 12
Hãy cho biết hiện tượng xảy ra khi tác dụng một lực cơ học đủ mạnh lên tấm kim loại. Giải thích.
Lời giải:
Khi tác dụng một lực cơ học đủ mạnh lên tấm kim loại, tấm kim loại sẽ bị dát mỏng hơn.
Điều này được giải thích do kim loại có tính dẻo. Tính dẻo này có được nhờ các electron tự do liên kết các lớp mạng trong tinh thể với nhau và chúng có thể trượt lên nhau khi chịu tác dụng của một lực cơ học nhưng không tách rời nhau.
Giải Hóa 12 trang 78 Chân trời
Luyện tập trang 78 SGK Hóa học 12
Hãy giải thích:
a) Tại sao tungsten (W) được dùng để làm dây tóc bóng đèn?
b) Tại sao lõi dây điện thường được làm từ kim loại đồng?
Lời giải:
a) Kim loại tungsten (W) chịu được nhiệt độ cao và có nhiệt độ nóng chảy cao nên được dùng để làm dây tóc bóng đèn.
b) Lõi dây điện được làm bằng đồng vì dẫn điện tốt, độ dẻo cao, giá thành phù hợp. Cụ thể:
- Nhiệm vụ của dây dẫn điện là truyền điện từ nguồn điện đến vật tiêu thụ điện để phục vụ đời sống con người nên lõi của nó phải là chất dẫn điện.
- Mặc dù vàng, bạc và đồng đều là chất dẫn điện tốt (tốt nhất là vàng, đến bạc rồi mới đến đồng) nhưng vàng và bạc là những kim loại quý hiếm nên đắt, còn đồng có nhiều hơn. Ngoài ra, đồng vừa dẻo, vừa dai nên dễ kéo thành những sợi nhỏ nhưng vẫn bền và giá thành rẻ hơn vàng, bạc nhiều.
Thảo luận 5 trang 78 SGK Hóa học 12
Tiến hành Thí nghiệm 1 và nêu hiện tượng xảy ra. Xác định vai trò của các chất trong các phản ứng hoá học xảy ra ở thí nghiệm này.
Lời giải:
|
Thí nghiệm 1 |
Hiện tượng xảy ra |
Vai trò các chất trong phản ứng |
|
Sắt phản ứng với chlorine: Lấy sợi dây sắt cuốn thành hình lò xo. Dùng kẹp đốt hoá chất gắp dây sắt, nung nóng đỏ sợi dây sắt trên ngọn lửa đèn cồn, đưa nhanh vào bình chứa khí chlorine. |
Dây sắt cháy trong khí chlorine tạo thành hỗn hợp có màu nâu đỏ. |
Trong phản ứng: Fe đóng vai trò là chất khử; Cl2 đóng vai trò là chất oxi hoá. |
|
Magnesium phản ứng với oxygen: Dùng kẹp đốt hoá chất gắp dây magnesium, đốt nóng trong không khí đến khi xuất hiện tia sáng thì ngừng đốt. |
Sợi dây magnesium cháy mãnh liệt cho ngọn lửa sáng chói. |
Trong phản ứng: Mg đóng vai trò là chất khử; O2 đóng vai trò là chất oxi hoá. |
|
Sắt phản ứng với lưu huỳnh: Lấy một thìa nhỏ bột sắt và một thìa nhỏ bột lưu huỳnh, trộn đều và cho vào ống nghiệm. Đun nóng ống nghiệm chứa hỗn hợp trên ngọn lửa đèn cồn đến khi có đốm sáng đỏ xuất hiện trong ống nghiệm thì ngừng đun, tắt đèn cồn. |
Hỗn hợp cháy sáng, phản ứng toả nhiều nhiệt. |
Trong phản ứng: Fe đóng vai trò là chất khử; S đóng vai trò là chất oxi hoá. |
Giải Hóa 12 trang 79 Chân trời
Thảo luận 6 trang 79 SGK Hóa học 12
Dựa vào thế điện cực chuẩn trong Bảng 12.1, hãy cho biết kim loại nào có khả năng phản ứng được với dung dịch HCl hoặc dung dịch H2SO4 loãng giải phóng khí H2.
Lời giải:
Kim loại có ![]() \(E_{M^{n+}/M }^{0}\) có thể phản ứng với dung dịch HCl hoặc dung dịch H2SO4 loãng giải phóng khí H2.
\(E_{M^{n+}/M }^{0}\) có thể phản ứng với dung dịch HCl hoặc dung dịch H2SO4 loãng giải phóng khí H2.
Thảo luận 7 trang 79 SGK Hóa học 12
Tiến hành Thí nghiệm 2 và nêu hiện tượng xảy ra. Xác định vai trò của các chất trong các phản ứng hoá học xảy ra ở Thí nghiệm 2.
Lời giải:
|
Thí nghiệm 2 |
Hiện tượng xảy ra |
Vai trò các chất trong phản ứng |
|
Kim loại phản ứng với dung dịch HCl: Cho một mẩu đồng vào ống nghiệm (1) và một mẩu sắt vào ống nghiệm (2). Cho vào mỗi ống nghiệm khoảng 2 mL dung dịch HCl 1M. |
- Ống nghiệm 1: không có hiện tượng gì xuất hiện. - Ống nghiệm 2: mẩu sắt tan dần, có khí thoát ra. |
Fe đóng vai trò là chất khử, HCl đóng vai trò là chất oxi hoá. |
|
Kim loại phản ứng với dung dịch H2SO4 loãng: Cho một mẩu đồng vào ống nghiệm (3) và một mẩu sắt vào ống nghiệm (4). Cho vào mỗi ống nghiệm khoảng 2 mL dung dịch H2SO4 0,5 M. |
- Ống nghiệm 1: không có hiện tượng gì xuất hiện. - Ống nghiệm 2: mẩu sắt tan dần, có khí thoát ra. |
Fe đóng vai trò là chất khử, H2SO4 đóng vai trò là chất oxi hoá. |
|
Kim loại phản ứng với dung dịch H2SO4 đặc: Cho một mẩu đồng vào ống nghiệm (5). Cho vào ống nghiệm khoảng 2 mL dung dịch H2SO4 98%. Dùng bông tẩm dung dịch NaOH đậy trên miệng ống nghiệm rồi đun nóng nhẹ ống nghiệm (5) trên ngọn lửa đèn cồn. |
Mẩu đồng tan dần, có khí thoát ra mạnh. Dung dịch sau phản ứng có màu xanh. |
Cu đóng vai trò là chất khử, H2SO4 đóng vai trò là chất oxi hoá. |
Giải Hóa 12 trang 80 Chân trời
Thảo luận 8 trang 80 SGK Hóa học 12
Dựa vào thế điện cực chuẩn trong Bảng 12.1, hãy cho biết kim loại nào có khả năng phản ứng được với nước ở điều kiện thường giải phóng khí H2.
Lời giải:
Kim loại có ![]() \(E_{M^{n+}/M }^{0}\) < −0,42V có thể phản ứng với nước ở điều kiện thường giải phóng khí H2.
\(E_{M^{n+}/M }^{0}\) < −0,42V có thể phản ứng với nước ở điều kiện thường giải phóng khí H2.
Thảo luận 9 trang 80 SGK Hóa học 12
Dựa vào thế điện cực chuẩn trong Bảng 12.1, hãy cho biết kim loại nào có khả năng đẩy được đồng ra khỏi dung dịch CuSO4 1 M.
Lời giải:
Những kim loại có thế điện cực chuẩn của cặp oxi hoá – khử nhỏ hơn ![]() \(E_{Cu^{2+} /Cu}^{0}\) = 0,34 V có khả năng đẩy được đồng ra khỏi dung dịch CuSO4 1 M.
\(E_{Cu^{2+} /Cu}^{0}\) = 0,34 V có khả năng đẩy được đồng ra khỏi dung dịch CuSO4 1 M.
Thảo luận 10 trang 80 SGK Hóa học 12
Tiến hành Thí nghiệm 3 và nêu hiện tượng xảy ra. Xác định vai trò của các chất trong phản ứng hoá học xảy ra ở Thí nghiệm 3.
Lời giải:
|
Thí nghiệm 3 Kim loại phản ứng với dung dịch muối |
Hiện tượng xảy ra |
Vai trò các chất |
|
Cho mẩu đồng vào hai ống nghiệm. Cho khoảng 2 mL dung dịch AgNO3 vào ống nghiệm (1) và cho khoảng 2 mL dung dịch ZnSO4 vào ống nghiệm (2). |
- Ống nghiệm 1: Có lớp kim loại trắng bạc bám ngoài mẩu đồng, dung dịch phản ứng chuyển dần sang màu xanh. - Ống nghiệm 2: Không có hiện tượng gì. |
Cu đóng vai trò là chất khử; AgNO3 đóng vai trò là chất oxi hoá. |
Bài 1 trang 80 SGK Hóa học 12
Thuỷ ngân dễ bay hơi và rất độc. Khi nhiệt kế thuỷ ngân bị vỡ có thể dùng bột lưu huỳnh để xử lí thuỷ ngân. Giải thích.
Lời giải:
Thuỷ ngân dễ bay hơi và rất độc. Khi nhiệt kế thuỷ ngân bị vỡ có thể dùng bột lưu huỳnh để xử lí thuỷ ngân. Do thuỷ ngân có thể tác dụng ngay với lưu huỳnh ở điều kiện thường tạo thành chất rắn khó bay hơi, dễ dàng thu gom, xử lí.
Hg (l) + S (s) → HgS(s)
Bài 2 trang 80 SGK Hóa học 12
Tại sao đồng dẫn điện tốt hơn nhôm nhưng dây điện cao thế thường được làm bằng nhôm mà không làm bằng đồng? Cho biết khối lượng riêng của đồng là 8,96 g/cm3, của nhôm là 2,70 g/cm3.
Lời giải:
Dây điện cao thế thường làm bằng kim loại nhôm mà không làm bằng kim loại đồng vì nhôm nhẹ, làm giảm áp lực lên cột điện, phòng tránh được gãy, đổ cột điện. Ngoài ra, giá thành của kim loại nhôm cũng rẻ hơn so với kim loại đồng.
Bài 3 trang 80 SGK Hóa học 12
Để làm tinh khiết bột đồng có lẫn các kim loại thiếc, kẽm, người ta có thể ngâm hỗn hợp trên vào lượng dư dung dịch Cu(NO3)2. Giải thích và viết phương trình hoá học của các phản ứng xảy ra (nếu có).
Lời giải:
Đang cập nhật...
Bài tiếp theo: Giải Hóa 12 Chân trời sáng tạo bài 15