Giải Hóa 12 Cánh diều bài 10
Giải Hóa 12 Cánh diều bài 10: Thế điện cực chuẩn của kim loại
VnDoc.com xin gửi tới bạn đọc bài viết Giải Hóa 12 Cánh diều bài 10: Thế điện cực chuẩn của kim loại để bạn đọc cùng tham khảo. Bài viết hướng dẫn trả lời chi tiết các câu hỏi trong SGK Hóa học 12 Cánh diều các trang 70, 71, 73, 75.
Giải Hóa 12 trang 70 Cánh diều
Mở đầu trang 70 SGK Hóa 12
Cho hai kim loại X và Y cùng hai cation tương ứng là Xm+ và Yn+. Xét phản ứng hoá học:
nX(s) + mYn+(aq) → nXm+(aq) + mY(s)
a) Phản ứng hoá học trên thuộc loại phản ứng nào?
b) Có thể dự đoán chiều của phản ứng hoá học trên dựa vào cơ sở nào?
Lời giải:
a) Phản ứng trên thuộc loại phản ứng oxi hóa-khử.
b) Có thể dự đoán chiều của phản ứng hoá học trên dựa vào thế điện cực chuẩn của kim loại.
Nguyên tắc:
Chất oxi hóa mạnh hơn + Chất khử mạnh hơn --> Chất khử yếu hơn + Chất oxi hóa yếu hơn
Khi biết thế điện cực chuẩn của hai cặp oxi hóa – khử, có thể xác định được chất oxi hóa mạnh hơn và chất khử mạnh hơn, từ đó dự đoán được chiều diễn ra của phản ứng oxi hóa – khử ở điều kiện chuẩn.
Câu hỏi 1 trang 70 SGK Hóa 12
Cho hai phản ứng sau:
Zn(s) + Cu2+(aq) → Zn2+(aq) + Cu(s) (1)
Cu(s) + 2Ag+(aq) → Cu2+(aq) + 2Ag(s) (2)
Hãy xác định chất oxi hoá, chất khử trong mỗi phản ứng trên.
Lời giải:
Phản ứng (1): Chất khử là Zn, chất oxi hóa là Cu2+
Phản ứng (2): Chất khử là Cu, chất oxi hóa là Ag+
Giải Hóa 12 trang 71 Cánh diều
Luyện tập 1 trang 71 SGK Hóa 12
Viết các cặp oxi hóa – khử của các kim loại trong hai phản ứng (1) và (2) ở trên.
Lời giải:
Phản ứng (1): Zn2+/Zn; Cu2+/Cu.
Phản ứng (2): Cu2+/Cu; Ag+/Ag.
Luyện tập 2 trang 71 SGK Hóa 12
Hãy viết cặp oxi hóa – khử của các kim loại trong dãy sau:

Lời giải:
Cặp oxi hóa khử: Mg2+/Mg; Al3+/Al; Zn2+/Zn; Fe2+/Fe; Fe3+/Fe; Fe3+/Fe2+; Sn2+/Sn; Pb2+/Pb; 2H+/H2; Cu2+/Cu; Cu+/Cu; Cu2+/Cu+; Ag+/Ag; Au3+/Au.
Giải Hóa 12 trang 73 Cánh diều
Câu hỏi 2 trang 73 SGK Hóa 12
So sánh thế điện cực chuẩn của cặp oxi hoá khử Fe2+/Fe và Pb2+/Pb. Từ đó, so sánh tính oxi hoá của Fe2+ và Pb2+, tính khử của Fe và Pb.
Lời giải:
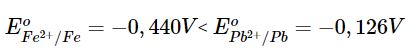
⟹ Tính oxi hóa của Fe2+ yếu hơn tính oxi hóa của Pb2+.
Tính khử của Fe mạnh hơn tính khử của Pb
Luyện tập 3 trang 73 SGK Hóa 12
Hãy sắp xếp dãy các ion sau theo chiều tăng dần tính oxi hoá: Na+, Zn2+, Au3+, Ni2+, H+.
Lời giải:
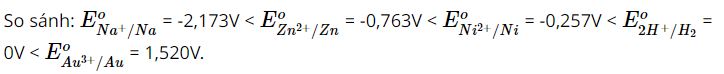
⟹ Sắp xếp dãy các ion theo chiều tăng dần tính oxi hóa là:
Na+ < Zn2+ < Ni2+ < H+ < Au3+
Giải Hóa 12 trang 74 Cánh diều
Câu hỏi 3 trang 74 SGK Hóa 12
Phản ứng nào sau đây có thể xảy ra ở điều kiện chuẩn? Giải thích.
a) Cu(s) + Fe3+(aq) → ?
b) Ag(s) + Sn2+(aq) → ?
Lời giải:

Giải Hóa 12 trang 75 Cánh diều
Bài 1 trang 75 SGK Hóa 12
Kim loại M tan được trong dung dịch HCl 1 M ở 25°C tạo muối MCln và H2. Hãy so sánh giá trị thể điện cực chuẩn của cặp Mn+/M và 2H+/H2. Giải thích.
Lời giải:
2M + 2nH+ ⟶ 2Mn+ + nH2
Dựa vào phản ứng ta thấy H+ có tính oxi hóa mạnh hơn Mn+, M có tính khử mạnh hơn H2 ⟹ ![]()
Bài 2 trang 75 SGK Hóa 12
Cho các cặp oxi hoá khử sau:
a) Mg2+/Mg và Cu2+/Cu
b) Zn2+/Zn và Fe2+/Fe.
c) Ag+/Ag và Au3+/Au.
Viết các phương trình hóa học của phản ứng theo chiều tự diễn biến từ các cặp oxi hoá – khử tương ứng đã cho.
Lời giải:
a) Mg + Cu2+ ⟶ Mg2+ + Cu
b) Zn + Fe2+ ⟶Zn2+ + Fe
c) 3Ag + Au3+ ⟶ 3Ag+ + Au
Bài 3 trang 75 SGK Hóa 12
Thế điện cực chuẩn của cặp M+/M (M là kim loại) bằng –3,040 V. Những phát biểu liên quan đến cặp oxi hoá – khử M+/M nào sau đây là đúng?
(a) M là kim loại có tính khử mạnh.
(b) Ion M+ có tính oxi hoá yếu.
(c) M là kim loại có tính khử yếu.
(d) Ion M+ có tính oxi hoá mạnh.
Lời giải:
Đang cập nhật...
Bài 4 trang 75 SGK Hóa 12
Chromium (Cr) thường được sử dụng để mạ lên kim loại do Cr tạo được lớp phủ sáng bóng. Hãy cho biết thiết bị kim loại được mạ Cr có bền trong môi trường là dung dịch Fe(NO3)2 không. Giải thích. Cho biết thế điện cực chuẩn của cặp Cr2+/Cr là -0,910 V.
Lời giải:
Đang cập nhật...
Bài tiếp theo: Giải Hóa 12 Cánh diều bài 11










