Giải Hóa 12 Kết nối tri thức bài 25
Giải Hóa 12 Kết nối tri thức bài 25: Nguyên tố nhóm IIA
VnDoc.com xin gửi tới bạn đọc bài viết Giải Hóa 12 Kết nối tri thức bài 25: Nguyên tố nhóm IIA để bạn đọc cùng tham khảo. Bài viết hướng dẫn trả lời chi tiết các câu hỏi trong SGK Hóa học 12 Kết nối tri thức trang 117, 119, ...., 124.
Giải Hóa 12 trang 116 Kết nối
Mở đầu trang 116 SGK Hóa học 12
Trong nhóm IIA, magnesium và calcium là hai nguyên tố phổ biến nhất, đồng thời có vai trò quan trọng với sự sinh trưởng, phát triển của động vật và thực vật. Magnesium có trong chất diệp lục, calcium có trong vỏ và mai các loài giáp xác, trong xương và răng của người và động vật.... Ngoài ra, đơn chất và hợp chất nhóm IIA có nhiều ứng dụng phổ biến trong đời sống, sản xuất. Vậy, đơn chất nhóm IIA có đặc điểm gì nổi bật về tính chất vật lí và tính chất hoá học? Các hợp chất phổ biến của calcium có vai trò như thế nào với đời sống, sản xuất và cơ thể con người?

Lời giải:
- Tính chất vật lí đơn chất nhóm IIA: Kim loại nhóm IIA có nhiệt độ nóng chảy cao hơn nhiệt độ nóng chảy của kim loại nhóm IA, nhưng tương đối thấp so với nhiệt độ nóng chảy của các kim loại khác. Kim loại nhóm IIA đều là kim loại nhẹ, có khối lượng riêng tương đối nhỏ.
- Tính chất hoá học đơn chất nhóm IIA: Kim loại nhóm IIA có tính khử mạnh, chỉ kém kim loại nhóm IA.
- Vai trò hợp chất nhóm IIA với đời sống, sản xuất và cơ thể con người: Các nguyên, vật liệu chứa calcium như đá vôi, vôi, nước vôi, thạch cao, quặng apatite, quặng fluorite … có nhiều ứng dụng trong đời sống và sản xuất:

Một số hợp chất của calcium còn có vai trò quan trọng đối với cơ thể con người như: calcium phosphate, hydroxylapatite tham gia cấu tạo của xương và răng.
Giải Hóa 12 trang 117 Kết nối
Hoạt động trang 117 SGK Hóa học 12
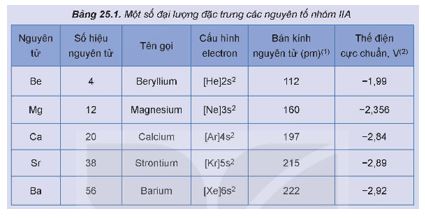
Một số đại lượng đặc trưng của các nguyên tố nhóm IIA được trình bày trong Bảng 25.1.
Thực hiện các yêu cầu sau:
1. Nhận xét xu hướng biến đổi bán kính nguyên tử của nguyên tố nhóm IIA.
2. Dựa vào bán kính nguyên tử, điện tích hạt nhân, dự đoán xu hướng biến đổi tính khử từ Be đến Ba.
3. Dự đoán số oxi hoá đặc trưng của nguyên tử của nguyên tố nhóm IIA. Giải thích.
Lời giải:
1. Xu hướng biến đổi bán kính nguyên tử của nguyên tố nhóm IIA: Theo chiều từ trên xuống dưới (chiều tăng dần của điện tích hạt nhân) bán kính nguyên tử tăng dần.
2. Dự đoán xu hướng biến đổi tính khử từ Be đến Ba: tính khử tăng dần.
3. Dự đoán số oxi hoá đặc trưng của nguyên tử của nguyên tố nhóm IIA trong hợp chất là +2. Do nguyên tử của nguyên tố nhóm IIA có 2 electron ở lớp ngoài cùng, dễ nhường 2 electron này để đạt cấu hình electron bền vững của khí hiếm.
Câu hỏi 1 trang 117 SGK Hóa học 12
Tại sao trong tự nhiên, các nguyên tố nhóm IIA chỉ tồn tại ở dạng hợp chất?
Lời giải:
Kim loại nhóm IIA có thế điện cực chuẩn ![]() \(E_{M^{2+} /M }^{o}\) nhỏ nên dễ tách electron hoá trị ra khỏi nguyên tử, thể hiện tính khử mạnh. Do đó, trong tự nhiên, các nguyên tố nhóm IIA chỉ tồn tại ở dạng hợp chất.
\(E_{M^{2+} /M }^{o}\) nhỏ nên dễ tách electron hoá trị ra khỏi nguyên tử, thể hiện tính khử mạnh. Do đó, trong tự nhiên, các nguyên tố nhóm IIA chỉ tồn tại ở dạng hợp chất.
Giải Hóa 12 trang 118 Kết nối
Hoạt động trang 118 SGK Hóa học 12
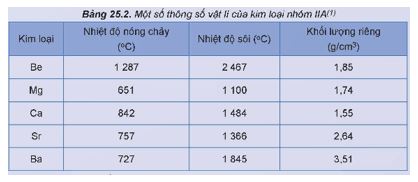
Một số thông số vật lí của kim loại nhóm IIA được trình bày trong Bảng 25.2.
Thực hiện các yêu cầu sau:
1. So sánh nhiệt độ nóng chảy của kim loại nhóm IIA với kim loại nhóm IA trong cùng chu kì.
2. Trong nhóm IIA, kim loại nào là kim loại nhẹ?
Lời giải:
1. Trong cùng một chu kì, kim loại nhóm IIA có nhiệt độ nóng chảy cao hơn nhiệt độ nóng chảy của kim loại nhóm IA.
2. Kim loại nhóm IIA đều là kim loại nhẹ do các kim loại nhóm IIA đều có khối lượng riêng nhỏ hơn 5 g/cm3.
Giải Hóa 12 trang 119 Kết nối
Hoạt động trang 119 SGK Hóa học 12
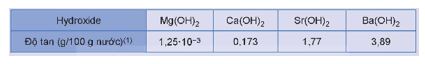
Độ tan trong nước của các hydroxide nhóm IIA ở 20oC cho trong bảng sau:
Thực hiện các yêu cầu sau:
1. Nêu xu hướng biến đổi độ tan của các hydroxide nhóm IIA.
2. Dự đoán xu hướng phản ứng với nước của kim loại nhóm IIA (từ Mg đến Ba) dựa vào độ tan trong nước của các hydroxide.
Lời giải:
1. Đi từ Mg(OH)2 đến Ba(OH)2 độ tan trong nước của các hydroxide nhóm IIA tăng dần.
2. Dựa vào độ tan trong nước của các hydroxide dự đoán mức độ phản ứng với nước của kim loại nhóm IIA (từ Mg đến Ba) tăng dần.
Hoạt động trang 119 SGK Hóa học 12
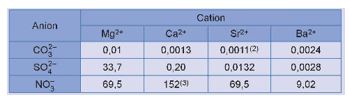
Độ tan (g/100 g nước) của các muối sulfate, carbonate và nitrate của kim loại nhóm IIA ở 20oC cho trong bảng sau:
Thực hiện yêu cầu sau:
Nhận xét về khả năng hoà tan (dễ tan/ ít tan/ không tan) của các muối của kim loại nhóm IIA.
Lời giải:
Nhận xét:
+ Các muối nitrate đều dễ tan trong nước.
+ Các muối carbonate: MgCO3, CaCO3, SrCO3, BaCO3 đều không tan trong nước.
+ Muối MgSO4 tan, muối CaSO4 và SrSO4 ít tan, muối BaSO4 không tan trong nước.
Chú ý:
Độ tan của chất: S (g/100g H2O ở nhiệt độ thường).
+ Chất dễ tan: S > 1,0.
+ Chất ít tan: 0,01 < S ≤ 1.
+ Chất không tan: S ≤ 0,01.
Giải Hóa 12 trang 120 Kết nối
Hoạt động thí nghiệm trang 120 SGK Hóa học 12
So sánh độ tan giữa calcium sulfate và barium sulfate
Chuẩn bị:
Hoá chất: các dụng cụ CaCl2 1M, BaCl2 1M, CuSO4 1M.
Dụng cụ: ống nghiệm, giá ống nghiệm.
Tiến hành:
- Đặt 2 ống nghiệm vào giá. Thêm khoảng 2 mL dung dịch CaCl2 vào ống nghiệm (1),
2 mL dung dịch BaCl2 vào ống nghiệm (2).
- Nhỏ từ từ từng giọt dung dịch CuSO4 vào mỗi ống nghiệm cho đến khi xuất hiện kết tủa.
Quan sát hiện tượng xảy ra và thực hiện yêu cầu sau:
So sánh thời điểm xuất hiện kết tủa ở hai ống nghiệm và giải thích.
Lời giải:
Ở ống nghiệm (2) kết tủa xuất hiện trước. Do độ tan của BaSO4 là 0,0028 g/100 g nước còn độ tan của CaSO4 là 0,2 g/100 g nước.
Giải Hóa 12 trang 121 Kết nối
Câu hỏi 2 trang 121 SGK Hóa học 12
Đề xuất cách phân biệt 3 dung dịch bão hoà: CaCl2, SrCl2, BaCl2.
Lời giải:
- Đánh số thứ tự từng lọ hoá chất theo thứ tự 1, 2, 3, trích mỗi lọ một ít sang ống nghiệm đánh số tương ứng.
- Nhúng dây platinum vào ống nghiệm (1). Hơ nóng đầu dây trên ngọn lửa đèn khí.
- Rửa sạch dây platinum, tiến hành thí nghiệm tương tự với dung dịch ở ống nghiệm (2).
- Lặp lại quá trình ở ống nghiệm (3).
- Kết quả:
+ Nếu cho ngọn lửa màu đỏ cam → muối CaCl2.
+ Nếu cho ngọn lửa màu đỏ son → muối SrCl2.
+ Nếu cho ngọn lửa màu lục → BaCl2.
Hoạt động trang 121 SGK Hóa học 12
Muối carbonate của kim loại nhóm IIA là muối của acid yếu, tác dụng được với nhiều acid vô cơ và hữu cơ, giải phóng khí carbon dioxide.
1. Viết phương trình hoá học của phản ứng giữa CaCO3 với dung dịch HCl, với dung dịch CH3COOH.
2. Đề xuất cách làm sạch cặn đá vôi trong phích nước.
Lời giải:
1. Phương trình hoá học:
CaCO3 + 2HCl → CaCl2 + CO2 + H2O
CaCO3 + 2CH3COOH → (CH3COO)2Ca + CO2 + H2O
2. Để làm sạch cặn đá vôi (thành phần là CaCO3) trong phích nước ta có thể dùng giấm ăn hoặc nước chanh để súc rửa. Do giấm ăn hoặc nước chanh có chứa acid có thể tác dụng với cặn đá vôi tạo thành muối tan dễ bị rửa trôi.
Hoạt động trang 121 SGK Hóa học 12
Các muối carbonate của kim loại nhóm IIA đều bị phân huỷ bởi nhiệt:
MCO3(s) ![]() \(\overset{t^{o} }{\rightarrow}\) MO(s) + CO2 (g
\(\overset{t^{o} }{\rightarrow}\) MO(s) + CO2 (g![]() \(\triangle _{r} H_{298}^{0}\))
\(\triangle _{r} H_{298}^{0}\))
Biến thiên enthalpy chuẩn của quá trình trên được cho trong bảng sau:
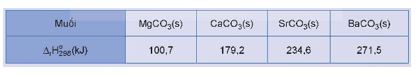
Thực hiện các yêu cầu sau:
Dựa vào biến thiên enthalpy chuẩn của phản ứng, dự đoán xu hướng biến đổi độ bền nhiệt của các muối carbonate của kim loại nhóm IIA.
Lời giải:
Dựa vào biến thiên enthalpy chuẩn của phản ứng, dự đoán độ bền nhiệt của các muối tăng dần theo thứ tự: MgCO3, CaCO3, SrCO3, BaCO3.
Giải Hóa 12 trang 122 Kết nối
Hoạt động trang 122 SGK Hóa học 12
Biến thiên enthalpy chuẩn của phản ứng nhiệt phân các muối nitrate của kim loại nhóm IIA:
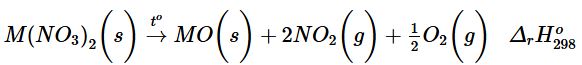
cho trong bảng sau:
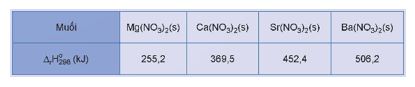
Thực hiện yêu cầu sau:
Dựa vào biến thiên enthalpy chuẩn của phản ứng, dự đoán xu hướng biến đổi độ bền nhiệt của muối nitrate của kim loại nhóm IIA.
Lời giải:
Dựa vào biến thiên enthalpy chuẩn của phản ứng, dự đoán độ bền nhiệt của các muối tăng dần theo thứ tự: Mg(NO3)2, Ca(NO3)2, Sr(NO3)2, Ba(NO3)2.
Hoạt động thí nghiệm trang 122 SGK Hóa học 12
Phân biệt từng ion riêng rẽ Ca2+ , Ba2+ , ![]() \(SO_{4}^{2-}\) ,
\(SO_{4}^{2-}\) , ![]() \(CO_{3}^{2-}\) có trong dung dịch
\(CO_{3}^{2-}\) có trong dung dịch
Chuẩn bị:
Hoá chất: các dung dịch: CaCl2 1 M, BaCl2 1 M, Na2SO4 1 M, Na2CO3 1M, HCl 2 M. Dụng cụ: ống nghiệm, giá ống nghiệm.
Tiến hành:
1. Nhận biết từng ion riêng rẽ Ca2+, Ba2+, ![]() \(SO_{4}^{2-}\).
\(SO_{4}^{2-}\).
Cho vào ống nghiệm (1) khoảng 1 mL dung dịch CaCl2 1 M, ống nghiệm (2) khoảng 1 mL dung dịch BaCl2 1 M, ống nghiệm (3) khoảng 1 mL Na2SO4 1 M.
- Nhỏ từ từ từng giọt dung dịch Na2SO4 1 M vào mỗi ống nghiệm (1) và ống nghiệm (2); nhỏ vài giọt dung dịch BaCl2 1 M vào ống nghiệm (3).
Chú ý: BaCl2 độc, cần tuân thủ quy tắc an toàn trong phòng thí nghiệm.
Quan sát hiện tượng xảy ra và thực hiện các yêu cầu sau:
1. Viết phương trình hoá học của các phản ứng xảy ra trong mỗi ống nghiệm.
2. Ở ống nghiệm (1) và (2), ống nào tạo kết tủa nhanh hơn? Nhiều hơn?
2. Nhận biết ion ![]() \(CO_{3}^{2-}\)
\(CO_{3}^{2-}\)
- Cho khoảng 1 mL dung dịch Na2CO3 1 M vào ống nghiệm, thêm tiếp khoảng 1 mL dung dịch CaCl2 1 M, lắc đều.
- Thêm tiếp 2 mL dung dịch HCl 2 M vào ống nghiệm, lắc đều.
Quan sát hiện tượng xảy ra và thực hiện các yêu cầu sau:
1. Viết phương trình hoá học của các phản ứng xảy ra trong thí nghiệm.
2. Nêu các hiện tượng xảy ra và giải thích.
Lời giải:
1. Nhận biết từng ion riêng rẽ Ca2+, Ba2+, ![]() \(SO_{4}^{2-}\)
\(SO_{4}^{2-}\)
1. Phương trình hoá học của các phản ứng xảy ra trong mỗi ống nghiệm.
Ống nghiệm 1: CaCl2 + Na2SO4 → CaSO4 + 2NaCl.
Ống nghiệm 2: BaCl2 + Na2SO4 → BaSO4 + 2NaCl.
Ống nghiệm 3: Na2SO4 + BaCl2 → BaSO4 + 2NaCl.
2. Ở ống nghiệm (1) và (2), ống nghiệm (2) tạo kết tủa nhanh hơn, nhiều hơn do độ tan tan của BaSO4 là 0,0028 g/100 g nước còn độ tan của CaSO4 là 0,2 g/100 g nước.
2. Nhận biết ion ![]() \(CO_{3}^{2-}\)
\(CO_{3}^{2-}\)
1. Phương trình hoá học của các phản ứng xảy ra trong thí nghiệm:
Na2CO3(aq) + CaCl2(aq) → CaCO3(s) + 2NaCl(aq)
CaCO3(s) + 2HCl(aq) → CaCl2(aq) + CO2(g) + H2O(l)
2.
|
Bước tiến hành |
Hiện tượng |
Giải thích |
|
- Cho khoảng 1 mL dung dịch Na2CO3 1 M vào ống nghiệm, thêm tiếp khoảng 1 mL dung dịch CaCl2 1 M, lắc đều. |
Xuất hiện kết tủa trắng. |
Na2CO3 phản ứng với CaCl2 sinh ra chất kết tủa là CaCO3 có màu trắng. Na2CO3(aq) + CaCl2(aq) → CaCO3(s) + 2NaCl(aq) |
|
- Thêm tiếp 2 mL dung dịch HCl 2 M vào ống nghiệm, lắc đều. |
Kết tủa tan dần, có khí thoát ra. |
Tiếp tục thêm HCl vào ống nghiệm, HCl phản ứng với CaCO3 tạo thành muối tan là CaCl2 và giải phóng khí CO2. CaCO3(s) + 2HCl(aq) → CaCl2(aq) + CO2(g) + H2O(l) |
Giải Hóa 12 trang 123 Kết nối
Câu hỏi 3 trang 123 SGK Hóa học 12
Tìm hiểu và trình bày vai trò của calcium trong cơ thể con người mà em biết.
Lời giải:
Calcium là thành phần chính của xương và răng; ion calcium có trong muối phosphate phức tạp, hydroxyapatite, Ca5(PO4)3OH. Ion Ca2+ trong cơ thể người có chức năng kích hoạt quá trình trao đổi chất, đóng vai trò quan trọng trong hoạt động của tim, đông máu, co cơ và truyền xung thần kinh.
Giải Hóa 12 trang 124 Kết nối
Câu hỏi 4 trang 124 SGK Hóa học 12
a) Khi đun nóng nước có tính cứng tạm thời, phần lớn ion Ca2+ và Mg2+ được tách ra khỏi nước ở dạng kết tủa muối carbonate.
Viết phương trình hoá học của các phản ứng xảy ra.
b) Giải thích sự tạo thành cặn đá vôi trong phích nước, ấm đun nước.
Lời giải:
a) Nước cứng tạm thời có chứa các ion Mg2+, Ca2+, ![]() \(HCO_{3}^{-}\)
\(HCO_{3}^{-}\)
Khi đun nóng nước có tính cứng tạm thời xảy ra các phản ứng sau:
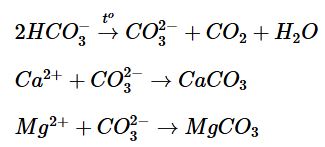
b) Cặn đá vôi (CaCO3) trong phích nước, ấm đun nước được giải thích bằng các phản ứng sau:
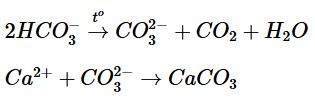
Câu hỏi 5 trang 124 SGK Hóa học 12
Trình bày về tác hại của nước cứng với sản xuất và đời sống.
Lời giải:
Nước cứng ảnh hưởng nhiều đến các hoạt động trong sản xuất và đời sống. Một số ví dụ về tác hại của nước cứng:
- Nồi hơi dễ bị đóng cặn gây tốn nhiên liệu và không an toàn.
- Đường ống dẫn nước dễ bị đóng cặn làm giảm lưu lượng nước hoặc tắc đường ống.
- Giặt bằng xà phòng sẽ tạo ra muối ít tan bám vào quần áo, xà phòng tạo ít bọt, tốn xà phòng, quần áo mau hỏng.
- Nấu ăn bằng nước cứng làm cho thực phẩm lâu chín, giảm mùi vị.
Hoạt động trang 124 SGK Hóa học 12
Đề xuất hai cách (không dùng hoá chất và có dùng hoá chất) để làm mềm mẫu nước có tính cứng tạm thời chứa Ca(HCO3)2 và Mg(HCO3)2. Viết phương trình hoá học để minh hoạ.
Lời giải:
- Cách 1: không dùng hoá chất.
Đun sôi nước, ion Ca2+ và Mg2+ sẽ tách ra dưới dạng kết tủa:
Ca(HCO3)2 ![]() \(\overset{t^{o} }{\rightarrow}\) CaCO3↓ + CO2↑ + H2O
\(\overset{t^{o} }{\rightarrow}\) CaCO3↓ + CO2↑ + H2O
Mg(HCO3)2 ![]() \(\overset{t^{o} }{\rightarrow}\) MgCO3↓ + CO2↑ + H2O
\(\overset{t^{o} }{\rightarrow}\) MgCO3↓ + CO2↑ + H2O
- Cách 2: dùng hoá chất:
Dùng lượng vừa đủ dung dịch Ca(OH)2:
Ca(HCO3)2 + Ca(OH)2 → 2CaCO3↓ + 2H2O
Mg(HCO3)2 + Ca(OH)2 → CaCO3↓ + MgCO3↓ + 2H2O
Ngoài ra có thể dùng dung dịch chứa ion ![]() \(CO_{3}^{2-}\) hoặc
\(CO_{3}^{2-}\) hoặc ![]() \(PO_{4}^{3-}\).
\(PO_{4}^{3-}\).
Hoạt động trang 124 SGK Hóa học 12
Đề xuất hai hoá chất có thể dùng để làm mềm mẫu nước có tính cứng vĩnh cửu chứa CaCl2 và MgSO4. Giải thích.
Lời giải:
Đề xuất hai hoá chất là Na2CO3 và Na3PO4.
Giải thích bằng phương trình hoá học:
CaSO4 + Na2CO3 → Na2SO4 + CaCO3↓
MgSO4 + Na2CO3 → Na2SO4 + MgCO3↓
3CaCl2 + 2Na3PO4 → 6NaCl + Ca3(PO4)2↓
3MgCl2 + 2Na3PO4 → 6NaCl + Mg3(PO4)2↓
Giải Hóa 12 trang 125 Kết nối
Em có thể trang 125 SGK Hóa học 12
Hiểu được tác hại của nước cứng với sản xuất, có thể đề xuất được hoá chất phù hợp để làm mềm nước cứng.
Lời giải:
Đang cập nhật...
Bài tiếp theo: Giải Hóa 12 Kết nối tri thức bài 26









