Giải Hóa 12 Kết nối tri thức bài 6
Giải Hóa 12 Kết nối tri thức bài 6: Tinh bột và cellulose
VnDoc.com xin gửi tới bạn đọc bài viết Giải Hóa 12 Kết nối tri thức bài 6: Tinh bột và cellulose với hướng dẫn trả lời chi tiết các câu hỏi trong SGK Hóa học 12 Kết nối tri thức các trang 28, 29, 30, 31, 32.
Giải Hóa 12 trang 28 Kết nối
Mở đầu trang 28 SGK Hoá 12
Tinh bột và cellulose đều là polysaccharide, nhưng chúng đóng vai trò khác nhau trong thực vật và có một số ứng dụng khác nhau trong cuộc sống. Vậy, về cấu tạo và tính chất của tinh bột và cellulose khác nhau như thế nào?
Lời giải:
Điểm khác nhau về cấu tạo và tính chất của tinh bột và cellulose:
|
|
Tinh bột |
Cellulose |
|
Cấu tạo |
Tinh bột gồm: amylose và amylopectin. + Phân tử amylose cấu tạo từ nhiều đơn vị α – glucose liên kết với nhau qua các liên kết α – 1,4 – glycoside và hình thành chuỗi xoắn. + Phân tử amylopectin có cấu tạo phân nhánh, gồm các chuỗi chứa nhiều đơn vị α – glucose liên kết với nhau qua các liên kết α – 1,4 – glycoside. Các chuỗi này liên kết với nhau tạo thành mạch nhánh qua liên kết α – 1,6 – glycoside. |
Phân tử cellulose cấu tạo từ nhiều đơn vị β – glucose qua liên kết β – 1,4 – glycoside và hình thành chuỗi không nhánh. |
|
Tính chất vật lí |
Tinh bột là chất rắn màu trắng, hầu như không tan trong nước lạnh. Trong nước nóng, tinh bột tan tạo dung dịch keo nhớt, gọi là hồ tinh bột. |
Cellulose là chất rắn, dạng sợi, màu trắng không tan trong nước ngay cả khi đun nóng, không tan trong các dung môi hữu cơ thông thường như benzene, ether … |
|
Tính chất hoá học |
Có phản ứng màu với dung dịch iodine. |
- Có phản ứng với nitric acid. - Bị hoà tan trong nước Schweizer. |
Giải Hóa 12 trang 29 Kết nối
Câu hỏi 1 trang 29 SGK Hoá 12
Cấu tạo của tinh bột và cellulose có những đặc điểm nào khác nhau?
Lời giải:
Điểm khác nhau về cấu tạo của tinh bột và cellulose:
|
|
Tinh bột |
Cellulose |
|
Cấu tạo |
Tinh bột gồm: amylose và amylopectin. + Phân tử amylose cấu tạo từ nhiều đơn vị α – glucose liên kết với nhau qua các liên kết α – 1,4 – glycoside và hình thành chuỗi xoắn. + Phân tử amylopectin có cấu tạo phân nhánh, gồm các chuỗi chứa nhiều đơn vị α – glucose liên kết với nhau qua các liên kết α – 1,4 – glycoside. Các chuỗi này liên kết với nhau tạo thành mạch nhánh qua liên kết α – 1,6 – glycoside. |
Phân tử cellulose cấu tạo từ nhiều đơn vị β – glucose qua liên kết β – 1,4 – glycoside và hình thành chuỗi không nhánh. |
Hoạt động thí nghiệm trang 29 SGK Hoá 12
Phản ứng thuỷ phân tinh bột
Chuẩn bị:
Hoá chất: dung dịch hồ tinh bột 1%, dung dịch CuSO4 5%, dung dịch NaOH 10%, dung dịch HCl 1 M, NaHCO3 rắn, nước nóng.
Dụng cụ ống nghiệm, cốc thuỷ tinh, bếp điện.
Tiến hành:
- Cho khoảng 5 mL dung dịch hồ tinh bột 1% vào ống nghiệm. Sau đó thêm khoảng 1 mL dung dịch HCl 1 M vào, lắc đều.
- Đặt ống nghiệm trong một cốc thuỷ tinh chứa nước nóng, đun cách thuỷ trong 10 phút. Sau đó để nguội.
- Thêm từ từ NaHCO3 vào đến khi ngừng sủi bọt khí.
- Cho khoảng 2 mL dung dịch thu được vào ống nghiệm chứa Cu(OH)2 (được điều chế bằng cách cho 0,5 mL dung dịch CuSO4 5% vào 2 mL dung dịch NaOH 10%, lắc nhẹ). Sau đó đặt ống nghiệm trong cốc thuỷ tinh chứa nước nóng khoảng 5 phút.
Quan sát hiện tượng xảy ra và rút ra nhận xét.
Lời giải:
|
Bước tiến hành |
Hiện tượng – giải thích |
|
- Cho khoảng 5 mL dung dịch hồ tinh bột 1% vào ống nghiệm. Sau đó thêm khoảng 1 mL dung dịch HCl 1 M vào, lắc đều. |
Thu được hỗn hợp huyền phù do hồ tinh bột không tan trong HCl. |
|
- Đặt ống nghiệm trong một cốc thuỷ tinh chứa nước nóng, đun cách thuỷ trong 10 phút. Sau đó để nguội. |
Thu được hỗn hợp đồng nhất, không có màu. (C6H10O5)n + nH2O t o , H + − − → →𝑡𝑜,𝐻+ nC6H12O6 |
|
- Thêm từ từ NaHCO3 vào đến khi ngừng sủi bọt khí. |
HCl phản ứng từ từ đến hết, do đó bọt khí dừng sủi. NaHCO3 + HCl → NaCl + CO2 + H2O |
|
- Cho khoảng 2 mL dung dịch thu được vào ống nghiệm chứa Cu(OH)2 (được điều chế bằng cách cho 0,5 mL dung dịch CuSO4 5% vào 2 mL dung dịch NaOH 10%, lắc nhẹ). Sau đó đặt ống nghiệm trong cốc thuỷ tinh chứa nước nóng khoảng 5 phút. |
Kết thúc phản ứng thu được kết tủa đỏ gạch: C6H12O6 + 2Cu(OH)2 + NaOH t o → →𝑡𝑜 CH2OH[CHOH]4COONa + Cu2O + 3H2O |
Nhận xét: Dưới tác dụng của acid, tinh bột bị thuỷ phân tạo thành glucose.
Hoạt động thí nghiệm 2 trang 29 SGK Hoá 12
Phản ứng màu của hồ tinh bột với iodine
Chuẩn bị:
Hoá chất: dung dịch iodine trong KI, dung dịch hồ tinh bột 1%.
Dụng cụ: ống nghiệm, ống hút nhỏ giọt.
Tiến hành: Lấy 2 mL dung dịch hồ tinh bột 1% vào ống nghiệm. Nhỏ tiếp vài giọt dung dịch iodine vào ống nghiệm, lắc đều.
Quan sát hiện tượng xảy ra và rút ra nhận xét.
Lời giải:
Hiện tượng: Xuất hiện màu xanh tím.
Nhận xét: Trong tinh bột, các phân tử amylose có dạng xoắn, khi tương tác với iodine tạo ra màu xanh tím. Phản ứng này dùng để nhận biết tinh bột.
Giải Hóa 12 trang 30 Kết nối
Hoạt động thí nghiệm trang 30 SGK Hoá 12
Phản ứng thuỷ phân cellulose trong môi trường acid
Chuẩn bị:
Hoá chất: cellulose (bông), dung dịch H2SO4 70%, dung dịch NaOH 10%, dung dịch CuSO4 5%, NaHCO3 rắn, nước nóng.
Dụng cụ: ống nghiệm, cốc thuỷ tinh 250 mL, đũa thuỷ tinh, đèn cồn, giá đựng ống nghiệm.
Tiến hành:
- Cho 10 mL dung dịch H2SO4 70% vào cốc thuỷ tinh, thêm một lượng nhỏ cellulose (bông) vào cốc và dùng đũa thuỷ tinh khuấy đều. Sau đó, đặt cốc thuỷ tinh vào cốc nước nóng và khuấy trong khoảng 3 phút để cellulose tan hết tạo dung dịch đồng nhất.
- Trung hoà dung dịch bằng cách thêm từ từ NaHCO3 đến khi dừng sủi bọt khí, sau đó thêm tiếp 5 mL dung dịch NaOH 10%.
- Cho 5 mL dung dịch thu được ở trên vào ống nghiệm chứa Cu(OH)2 (được điều chế bằng cách cho 0,5 mL dung dịch CuSO4 5% vào 2 mL dung dịch NaOH 10%, lắc nhẹ). Đun nóng đều ống nghiệm khoảng 2 phút, sau đó để ống nghiệm trên giá khoảng 3 phút.
Chú ý: Cần thận trọng khi làm việc với dung dịch H2SO4 đặc.
Quan sát hiện tượng xảy ra, giải thích và viết phương trình hoá học.
Lời giải:
|
Bước tiến hành |
Hiện tượng xảy ra |
Giải thích và viết phương trình hoá học |
|
- Cho 10 mL dung dịch H2SO4 70% vào cốc thuỷ tinh, thêm một lượng nhỏ cellulose (bông) vào cốc và dùng đũa thuỷ tinh khuấy đều. Sau đó, đặt cốc thuỷ tinh vào cốc nước nóng và khuấy trong khoảng 3 phút để cellulose tan hết tạo dung dịch đồng nhất. |
Cellulose tan hết tạo dung dịch đồng nhất. |
Cellulose bị thuỷ phân trong môi trường acid tạo thành glucose. (C6H10O5)n + nH2O
|
|
- Trung hoà dung dịch bằng cách thêm từ từ NaHCO3 đến khi dừng sủi bọt khí, sau đó thêm tiếp 5 mL dung dịch NaOH 10%. |
Xuất hiện bọt khí, sau đó bọt khí dừng sủi. |
HCl phản ứng từ từ với NaHCO3 đến hết, do đó bọt khí dừng sủi. NaHCO3 + HCl → NaCl + CO2 + H2O |
|
- Cho 5 mL dung dịch thu được ở trên vào ống nghiệm chứa Cu(OH)2 (được điều chế bằng cách cho 0,5 mL dung dịch CuSO4 5% vào 2 mL dung dịch NaOH 10%, lắc nhẹ). Đun nóng đều ống nghiệm khoảng 2 phút, sau đó để ống nghiệm trên giá khoảng 3 phút. |
Xuất hiện kết tủa đỏ gạch.
|
Glucose phản ứng với Cu(OH)2 trong môi trường kiềm, đun nóng, thu được kết tủa đỏ gạch là Cu2O. C6H12O6 + 2Cu(OH)2 + NaOH |
Câu hỏi 2 trang 30 SGK Hoá 12
Tại sao tinh bột và cellulose đều có thể dùng để sản xuất ethanol?
Lời giải:
Do thuỷ phân hoàn toàn tinh bột và cellulose bởi enzyme hoặc acid (HCl hoặc H2SO4 loãng) đều thu được glucose.
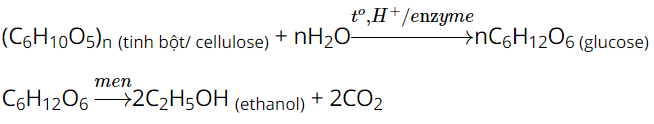
Hoạt động thí nghiệm trang 30 SGK Hoá 12
Phản ứng của cellulose với nitric acid
Chuẩn bị:
Hoá chất: cellulose (bông), dung dịch HNO3 đặc, dung dịch H2SO4 đặc, dung dịch NaHCO3 loãng, quỳ tím.
Dụng cụ: cốc thuỷ tinh 100 mL, chậu nước nóng, chậu nước đá, đũa thuỷ tinh, giấy lọc, đĩa sứ, đèn cồn.
Tiến hành:
- Cho khoảng 5 mL dung dịch HNO3 đặc vào cốc thuỷ tinh (loại 100 mL) ngâm trong chậu nước đá. Thêm từ từ khoảng 10 mL dung dịch H2SO4 đặc vào cốc và khuấy đều. Sau đó, lấy cốc thuỷ tinh ra khỏi chậu nước đá, thêm tiếp một nhúm bông vào cốc và dùng đũa thuỷ tinh ấn bông ngập trong dung dịch.
- Ngâm cốc trong chậu nước nóng khoảng 10 phút. Để nguội, lấy sản phẩm thu được ra khỏi cốc, rửa nhiều lần với nước lạnh (đến khi nước rửa không làm đổi màu quỳ tím), sau đó rửa lại bằng dung dịch NaHCO3 loãng.
- Ép sản phẩm giữa hai miếng giấy lọc để hút nước và làm khô tự nhiên. Sau đó, để sản phẩm lên đĩa sứ rồi đốt cháy sản phẩm.
Chú ý: Cần thận trọng khi làm việc với dung dịch HNO3 đặc và dung dịch H2SO4 đặc. Quan sát hiện tượng xảy ra, giải thích và viết phương trình hoá học.
Lời giải:
Hiện tượng:
- Miếng bông trên đĩa sứ cháy nhanh, không xuất hiện khói, không để lại tàn.
Giải thích:
Khi đun nóng cellulose với hỗn hợp HNO3 đặc và H2SO4 đặc, tuỳ theo điều kiện phản ứng mà một, hai hay cả ba nhóm hydroxy trong cellulose có thể phản ứng với nitric acid tạo thành cellulose nitrate, cellulose dinitrate hay cellulose trinitrate. Ví dụ:
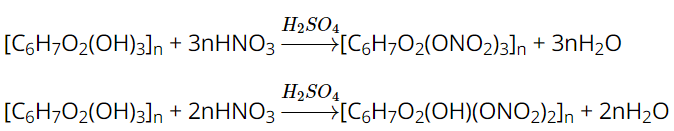
Các hợp chất này cháy nhanh, không xuất hiện khói, không để lại tàn.
Giải Hóa 12 trang 31 Kết nối
Hoạt động thí nghiệm trang 31 SGK Hoá 12
Tính tan của cellulose trong nước Schweizer
Chuẩn bị:
Hoá chất: cellulose (bông), dung dịch CuSO4 1 M, dung dịch NaOH 20%, dung dịch NH3 đặc.
Dụng cụ: giấy lọc, cốc thuỷ tinh 250 mL, đũa thuỷ tinh, ống hút.
Tiến hành:
- Cho khoảng 50 mL dung dịch CuSO4 1 M vào cốc 250 mL. Thêm 20 mL dung dịch NaOH 20% vào, khuấy đều.
- Lọc tách kết tủa, cho vào cốc thuỷ tinh 250 mL. Thêm khoảng 50 mL dung dịch NH3 đặc, khuấy đều đến khi kết tủa tan hết thu được nước Schweizer.
- Thêm một lượng nhỏ bông vào khoảng 30 mL nước Schweizer và khuấy đều trong khoảng 3 phút.
Quan sát hiện tượng xảy ra, giải thích và viết phương trình hoá học.
Lời giải:
|
Bước tiến hành |
Hiện tượng |
Giải thích và viết phương trình hoá học |
|
- Cho khoảng 50 mL dung dịch CuSO4 1 M vào cốc 250 mL. Thêm 20 mL dung dịch NaOH 20% vào, khuấy đều. |
Thu được kết tủa màu xanh. |
CuSO4 phản ứng với NaOH thu được kết tủa xanh là Cu(OH)2. CuSO4 + 2NaOH → Cu(OH)2↓ + Na2SO4 |
|
- Lọc tách kết tủa, cho vào cốc thuỷ tinh 250 mL. Thêm khoảng 50 mL dung dịch NH3 đặc, khuấy đều đến khi kết tủa tan hết thu được nước Schweizer. |
Kết tủa tan hết thu được dung dịch có màu xanh lam. |
Cu(OH)2 trong NH3 tạo thành phức tan có màu xanh đặc trưng gọi là nước Schweizer. Cu(OH)2 + 4NH3 → [Cu(NH3)4](OH)2 |
|
- Thêm một lượng nhỏ bông vào khoảng 30 mL nước Schweizer và khuấy đều trong khoảng 3 phút. |
Bông tan trong nước Schweizer tạo thành dung dịch đồng nhất. |
Cellulose không tan trong nước nhưng tan trong nước Schweizer để được dung dịch đồng nhất. |
Giải Hóa 12 trang 32 Kết nối
Em có thể trang 32 SGK Hoá 12
- Lựa chọn và sử dụng một số nguồn cung cấp tinh bột hợp lí.
- Lựa chọn và sử dụng một số sản phẩm từ cellulose an toàn, hợp lí.
Lời giải:
- Tinh bột là nguồn lương thực chính của con người, tuy nhiên lượng tinh bột cho mỗi người trong bữa ăn tuỳ thuộc vào lứa tuổi, thói quen, cũng như tình trạng bệnh lí. Do đó, cần lựa chọn và sử dụng một số nguồn cung cấp tinh bột hợp lí.
Ví dụ: Người bệnh đái tháo đường nên ăn giảm tinh bột so với người bình thường (khoảng 1/3 tổng lượng); nên ăn tinh bột có trong các ngũ cốc nguyên hạt như gạo lứt, yến mạch và các loại đậu …
- Sử dụng các sản phẩm từ cellulose an toàn, hợp lí đồng nghĩa với việc lựa chọn nguồn gỗ được quản lí bền vững, giảm áp lực đối với hệ sinh thái và bảo vệ môi trường tự nhiên. Trong quá trình sử dụng các sản phẩm từ cellulose cần ngăn ngừa tiếp xúc với nước, vệ sinh đều đặn, thường xuyên kiểm tra mối mọt và tránh để vật sắc nhọn đè lên.
Bài tiếp theo: Giải Hóa 12 Kết nối tri thức bài 7










