Giải bài tập Hóa 11 nâng cao bài 2
Hóa học 11 - Phân loại các chất điện li
VnDoc xin giới thiệu tới các bạn học sinh tài liệu Giải bài tập Hóa 11 nâng cao bài 2, nội dung tài liệu gồm 7 bài tập trang 10 SGK kèm theo lời giải chi tiết sẽ là nguồn thông tin hữu ích để phục vụ công việc học tập của các bạn học sinh có kết quả cao hơn trong học tập. Mời các bạn cùng tham khảo chi tiết và tải về tại đây nhé.
Giải bài tập Hóa 11 nâng cao bài 2 phân loại các chất điện li vừa được VnDoc.com sưu tập và xin gửi tới bạn đọc cùng tham khảo. Bài viết được tổng hợp gồm có lời giải của 7 bài tập trong sách giáo khoa hóa học lớp 11 nâng cao. Qua bài viết bạn đọc có thể thấy được khái niệm độ điện li, khái niệm chất điện li mạnh, chất điện li yếu, cách viết phương trình điện li, phương pháp phân biệt chất điện li mạnh và chất điện li yếu... Mời các bạn cùng tham khảo chi tiết và tải về tại đây nhé.
Giải bài tập Hóa 11 nâng cao
Bài 1 (trang 10 sgk Hóa 11 nâng cao)
Độ điện li là gì? Thế nào là chất điện li mạnh, chất điện li yếu? Lấy một số thí dụ chất điện li mạnh, chất điện li yếu và viết phương trình điện li của chúng.
Lời giải:
* Độ điện li: Độ điện li của một chất là tỉ số phân tử chất tan đã điện li và số phân tử chất tan ban đầu.
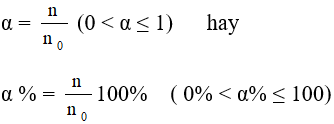
- Các axit mạnh: HCl, HBr, HI, HNO3, HClO4, H2SO4,…
HCl → H+ + Cl-;
HNO3 → H+ + NO3-
- Các bazơ mạnh: KOH, NaOH, Ba(OH)2,…
NaOH → Na+ + OH-
Ba(OH)2 → Ba2+ + 2OH-
- Các muối tan: NaCl, K2SO4, Ba(NO3)2,…
K2SO4 → 2K+ + SO42-;
Ba(NO3)2→ Ba2+ + 2NO3-
* Chất điện li yếu là chất khi tan trong nước chỉ có một phần số phân tử hòa tan phân li ra ion, phần còn lại vẫn tồn tại dưới dạng phân tử trong dung dịch.
+ Chất điện li yếu có α < 1 hoặc α% < 100%, gồm có:
- Các axit yếu: HF, H2CO3, H2SO3, H2S, H3PO4, CH3COOH,…
CH3COOH ↔ CH3COO- + H+
- Các bazơ yếu: NH3, Al(OH)3, Zn(OH)2, Mg(OH)2,…
Zn(OH)2 ↔ Zn2+ + 2OH-
Bài 2 (trang 10 sgk Hóa 11 nâng cao)
Chất điện li mạnh có độ điện li
A. α = 0.
B. α = 1.
C. α < 1.
D. 0 < α < 1.
Lời giải:
Chọn B.
Chất điện li mạnh có độ điện li α = 1.
Bài 3 (trang 10 sgk Hóa học 11 nâng cao)
Chất điện li yếu có độ điện li.
A. α = 0.
B. α = 1.
C. 0 < α < 1.
D. α < 0.
Lời giải:
Chọn C.
Chất điện li yếu có độ điện li 0 < α < 1.
Bài 4 (trang 10 sgk Hóa 11 nâng cao)
NaF là chất điện li mạnh, HF là chất điện li yếu. Bằng phương pháp thực nghiệm nào có thể phân biệt được chúng? Mô tả phương pháp đó.
Lời giải:
Lấy hai cốc đựng hai dung dịch trên có cùng nồng độ lắp vào bộ dụng cụ chứng minh tính dẫn điện của dung dịch (hình 1.1) SGK, nối các đầu dây dẫn điện với cùng nguồn điện bóng đèn ở cốc nào cháy sáng hơn là NaF (Nà là chất điện li mạnh); bóng đèn ở cốc nào cháy yếu hơn là HF (HF là chất điện li yếu).
Bài 5 (trang 10 sgk Hóa 11 nâng cao)
Tính nồng độ mol của cation và anion trong các dung dịch sau:
a) Ba(NO3)20,10M.
b) HNO3 0,020M.
c) KOH 0,010M.
Lời giải:
a) Ba(NO3)2→ Ba2+ + 2NO3-
0,1M → 0,1M → 0,2M
b) HNO3 → H+ + NO3-
0,02M → 0,02M → 0,02M
c) KOH → K+ + OH-
0,01M → 0,01M → 0,01M
Bài 6 (trang 10 sgk Hóa 11 nâng cao):
a) Chứng minh rằng độ điện li có thể tính bằng công thức sau:
α = C/Co
Trong đó Co là nồng độ mol của chất hòa tan, C là nồng độ mol của chất hòa tan phân li ra ion.
b) Tính nồng độ mol của CH3COOH, CH3COO- và H+ trong dung dịch CH3COOH 0,043M, biết rừng nồng độ điện li α của CH3COOH bằng 20%.
Lời giải:
a) Giả sử dung dịch chất điện li yếu có thể tích là V lít
Số phân tử hòa tan là no, số phân tử phân li thanh ion là n.
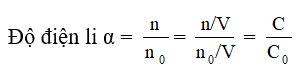
b) CH3COOH ↔ CH3COO- + H+
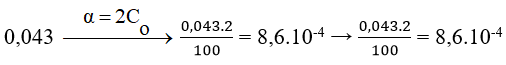
[CH3COO-] = [H+] = 8,6.10-4 mol/lít.
Bài 7 (trang 10 sgk Hóa 11 nâng cao)
Cân bằng sau tồn tại trong dung dịch: CH3COOH ↔ H+ + CH3COO-
Độ điện li α của CH3COOH sẽ biến đổi như thế nào?
a) Khi nhỏ vào vài giọt dung dịch HCl.
b) Khi pha loãng dung dịch.
c) Khi nhỏ vào vài giọt dung dịch NaOH.
Lời giải:
Xét cân bằng: CH3COOH ↔ H+ + CH3COO-
a) Khi thêm HCl nồng độ [H+] tăng ⇒ cân bằng dịch chuyển theo chiều nghịch tạo CH3COOH ⇒ số mol H+ và CH3COO-điện li ra ít ⇒ α giảm.
b) Khi pha loãng dung dịch, các ion dương và ion âm ở cách xa nhau hơn ít có điều kiện để va chạm vào nhau để tạo lại phân tử ⇒ α tăng.
Ta có α: ![]() \(\sqrt{\frac{K_A}{C}}\)
\(\sqrt{\frac{K_A}{C}}\)
Như vậy, V tăng ⇒ C = n/V giảm và KA không đổi
⇒ KA/C tăng ⇒ α tăng.
c) Khi nhỏ vào vài giọt dung dịch NaOH, ion OH- điện li ra từ NaOH sẽ lấy H+:
H+ + OH- → H2O, làm nồng độ H+ gảm ⇒ cân bằng dịch chuyển theo chiều thuận ⇒ số mol H+ và CH3COO- điện li ra nhiều ⇒ α tăng.
-----------------------------------
Trên đây VnDoc.com đã giới thiệu tới bạn đọc tài liệu: Giải bài tập Hóa 11 nâng cao bài 2. Để có kết quả cao hơn trong học tập, VnDoc xin giới thiệu tới các bạn học sinh tài liệu Sinh học lớp 11, Vật lý lớp 11, Giải bài tập Hóa học lớp 11, Giải bài tập Toán 11 mà VnDoc tổng hợp và đăng tải.
Mời bạn đọc cùng tham gia nhóm Tài liệu học tập lớp 11 để có thêm tài liệu học tập nhé








