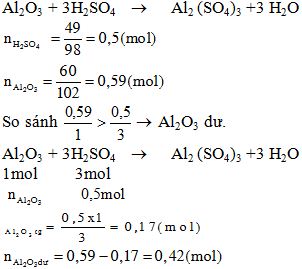Giáo án Hóa học 8 bài 38: Bài luyện tập 7
Giáo án Hóa học 8 bài 38
Giáo án Hóa học 8 bài 38: Bài luyện tập 7 có nội dung bám sát với chương trình của bài học, cách trình bày rõ ràng và chi tiết sẽ là tài liệu hữu ích cho các giáo viên giúp soạn giáo án nhanh hơn. Mời quý thầy cô và các bạn cùng tham khảo.
BÀI 38: LUYỆN TẬP 7
I. MỤC TIÊU: Sau bài này HS phải:
1. Kiến thức:
- Theo 5 mục ở phần kiến thức cần nhớ trang 131 sách GK (chủ yếu ôn tập 2 bài “Nước” và “Axit – Bazơ –Muối”
2. Kĩ năng:
- Viết phương trình phản ứng của nước với một số kimloại, oxit bazơ ,oxit axit.
- Gọi tên và phân loại sản phẩm thu được ,nhận biết được loại phản ứng.
- Viết được CTHH của một số axit, bazơ, muối khi biết hóa trị của kim loại và gốc axit, khi biết thành phần khối lượng các nguyên tố, biết được CTHH của axit, muối, bazơ khi biết tên.
- Phân biệt được một số dung dịch axit, bazơ cụ thể bằng giấy quỳ tím.
- Tính được khối lượng một số axit ,bazơ, muối tạo thành trong phản ứng.
3. Thái độ:
- Giúp HS yêu thích môn học.
4. Trọng tâm:
- Hóa tính của nước.
- Lập CTHH của axit ,bazơ ,muối và phân loại.
- Tính toán theo phương trình phản ứng :axit tác dụng bazơ tạo muối và nước, có lượng dư axit hoặc bazơ.
5. Năng lực cần hướng đến:
- Năng lực sử dụng ngôn ngữ hóa học, năng lực giải quyết vấn đề thông qua môn hóa học, năng lực tính toán.
II. CHUẨN BỊ:
1. Đồ dùng dạy học:
a. GV: Chuẩn bị một số bài tập về phân loại phản ứng và tính theo phương trình hoá học.
b. HS: Xem trước bài mới.
2. Phương pháp: Thảo luận nhóm – Đàm thoại – Làm việc cá nhân.
III. HOẠT ĐỘNG DẠY VÀ HỌC:
1. Ổn định lớp (1’):
|
Lớp |
Tên HS vắng học |
Lớp |
Tên HS vắng học |
|
8A1 |
8A4 |
||
|
8A2 |
8A5 |
||
|
8A3 |
2. Kiểm tra 15’:
Câu 1(5đ): Hãy phân loại các hợp chất thuộc loại axit, bazơ, muối: NaCl, H2SO4, HNO3, NaHCO3, CuSO4, HCl, Ca(OH)2, Al2(SO4)3, Fe(OH)3, KOH.
Câu 2 (5đ): Gọi tên các hợp chất trên.
ĐÁP ÁN:
|
AXIT |
BAZƠ |
MUỐI |
|
H2SO4: Axit sunphuric (1đ) |
Fe(OH)3: Sắt (III) hidroxit (1đ) |
CuSO4: Đồng sunphat (1đ) |
|
HCl: Axit clohidric (1đ) |
KOH: Kali hidroxit (1đ) |
NaCl: Natriclorua (1đ) |
|
HNO3: Axit nitric (1đ) |
Ca(OH)2: Canxi hidroxit (1đ) |
Al2(SO4)3: Nhôm sunphat (1đ) |
|
NaHCO3: Natri hidrocacbonat (1đ) |
3. Bài mới
a. Giới thiệu bài (1’): Để nắm vững thành phần và tính chất hoá học của nước. Định nghĩa, công thức phân loại, cách gọi tên axit, bazơ, oxit, muối.
b. Các hoạt động chính:
|
Hoạt động của GV |
Hoạt đông của HS |
|
Hoạt động 1: Kiến thức cần nhớ (10’) |
|
|
- GV: YC các nhóm thảo luận: + Nêu thành phần và tính chất hoá học của nước?
+ Nêu công thức chung, định nghĩa, tên gọi của bazơ, axit, muối? - GV: Nhận xét |
- HS: Các nhóm thảo luận và trả lời + Nước là hợp chất tạo bởi 2 nguyên tố hoá học là hidro và oxi a. Tác dụng với kim loại 2Na + 2H2O → 2NaOH + H2 b. Tác dụng với oxit bazơ H2O + CaO → Ca(OH)2 c. Tác dụng với oxit axit 3H2O + P2O5 → 2H3PO4 - HS: Trả lời - HS: Lắng nghe. |
|
Hoạt động 2: Luyện tập (15’) |
|
|
- GV: YC HS làm bài 1 / 131
- GV: Gọi 3 HS lên bảng làm bài2 / 132
- GV: Cho HS thảo luận nhóm bài 3 /132
- GV: Hướng dẫn HS làm bài 5 /132 - GV: Yêu cầu HS viết PTHH - GV: Yêu cầu HS tính , - GV: Hướng dẫn HS cách tính khối lượng dư
|
- HS: Làm bài 1 2Na +H2O → 2NaOH + H2 2K +H2O → 2 KOH + H2 Ca +H2O → Ca(OH)2 + H2 - HS: Lên bảng làm bài 2: Lập phương trình hoá học của các sơ đồ phản ứng a. Na2O +H2O → 2NaOH K2O +H2O → 2 KOH Sản phẩm thuộc loại bazơ NaOH: natri hidroxit KOH: kali hidroxit b. SO2 +H2O → H2SO3 SO3 +H2O → H2SO4 Sản phẩm thuộc loại axit H2SO3: axit sunfurơ H2SO4: axit sunfuric c. NaOH + HCl → NaCl + H2O 2Al(OH)3 + 3 H2SO4 → 6H2O + Al2 (SO4)3 Sản phẩm thuộc loại muối NaCl: natriclorua Al2 (SO4)3: nhôm sunfat - HS: thảo luận bài 3/ 132 Đồng (II)clorua: CuCl2 Kẽm sun fat: ZnSO4 Sắt III sun fat: Fe2 (SO4)3 Magiê hidro cacbocat: MgHCO3 Canxi photphat: Ca3(PO4)2 Natri hidro phot phat: NaHPO4 Natri đihidro photphat: NaH2PO4 - HS: Lắng nghe và thực hiện
mAl2O3dư = 0,42 x 102 = 42,84 (gam) |
4. Dặn dò: (3’)
- Dặn dò về nhà: làm lại bài tập: 1,2,3,4,5/132
- Chuẩn bị bài “Thực hành tính chất hóa học của nước”
IV. RÚT KINH NGHIỆM:
…………………………………………………………………………………………………………..
……………………………………………………………………………………………………………
……………………………………………………………………………………………………………