Giải bài tập Hóa học 12 SBT bài 27
Hóa học 12 - Nhôm và hợp chất của nhôm
Để giúp các bạn học sinh học tốt Hóa 12, VnDoc xin giới thiệu tới các bạn tài liệu Giải bài tập Hóa học 12 SBT bài 27. Nội dung tài liệu kèm theo lời giải chi tiết sẽ giúp các bạn học sinh rèn luyện giải Hóa học 12 một cách chính xác nhất. Mời các bạn tham khảo.
Giải bài tập Hóa học 12 SBT bài 26
Giải bài tập Hóa học 12 bài 27: Nhôm và hợp chất của nhôm
Giải bài tập Hóa học 12 SBT
Bài 6.50, 6.51,6.52, 6.53, 6.54 trang 62 sách bài tập (SBT) Hóa học 12
6.50. Nhôm hiđroxit thu được từ cách làm nào sau đây?
A. Cho dư dung dịch HCl vào dung dịch natri aluminat.
B. Thổi dư khí CO2 vào dung dịch natri aluminat.
C. Cho dư dung dịch NaOH vào dung dịch AlCl3.
D. Cho Al2O3 tác dụng với nước.
6.51. Chỉ dùng hoá chất nào sau đây có thể phân biệt 3 chất rắn là Mg, Al và Al2O3?
A. Dung dịch HCl
B. Dung dịch KOH
C. Dung dịch NaCl
D. Dung dịch CuCl2
6.52. Các dung dịch ZnSO4 và AlCl3 đéu không màu. Để phân biệt 2 dung dịch này có thế dùng dung dịch của chất nào sau đây?
A. NaOH
B. HNO3
C. HCl
D. NH3
6.53. Hiện tượng nào sau đây đúng khi cho từ từ dung dịch NH3 đến dư vào ống nghiệm đựng dung dịch AlCl3?
A. Sủi bọt khí, dung dịch vẫn trong suốt và không màu.
B. Sủi bọt khí và dung dịch đục dần do tạo ra chất kết tủa.
C. Dung dịch đục dần do tạo ra chất kết tủa sau đó kết tủa tan và dung dịch lại trong suốt.
D. Dung dịch đục dần do tạo ra chất kết tủa và kết tủa không tan khi chi dư dung dịch NH3.
6.54. Trong 1 lít dung dịch Al2(SO4)3 0,15M có tổng số mol các ion do mue phân li ra (bỏ qua sự thuỷ phân của muối) là
A. 0,15 mol.
B. 0,3 mol.
C. 0,45 mol.
D. 0,75 mol.
Hướng dẫn trả lời:
6.50. B
6.51. B
6.52. D
6.53. D
6.54. D
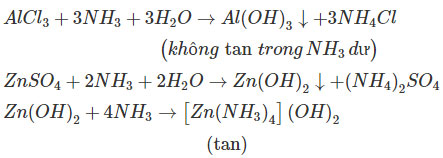
Bài 6.55, 6.56, 6.57, 6.58, 6.59, 6.60, 6.61 trang 63 sách bài tập (SBT) Hóa học 12
6.55. Hòa tan m gam Al tác dụng hết với dung dịch HNO3 rất loãng chỉ thu được hỗn hợp khí gồm 0,015 mol N2O và 0,01 mol NO. Giá trị của m là
A. 13,5.
B. 1,35.
C. 0,81.
D. 8,1.
6.56. Cho 5,4 g Al vào 100 ml dung dịch KOH 0,2M. Sau khi phản ứng xảy ra hoàn toàn thể tích khí H2 (đktc) thu được là
A. 4,48 lít.
B. 0,448 lít.
C. 0,672 lít.
D. 0,224 lít.
6.57. Nung nóng hỗn hợp gồm 10,8 g bột Al với 16 g bột Fe2O3 (không có không khí), nếu hiệu suất phản ứng là 80% thì khối lượng Al2O3 thu được là
A. 8,16 g.
B. 10,20 g.
C. 20,40 g.
D. 16,32 g.
6.58. Đốt cháy bột Al trong bình khí Cl2 dư, sau khi phản ứng xảy ra hoàn toàn khối lượng chất rắn trong bình tăng 4,26 g. Khối lượng Al đã phản ứng là
A. 2,16 g.
B. 1,62 g.
C. 1,08 g.
D. 3,24 g.
6.59. Cho 4,005 g AlCl3 vào 1000 ml dung dịch NaOH 0,1M. Sau khi phản ứng xong thu được khối lượng kết tủa là
A. 1,56 g
B. 2,34 g
C. 2,60 g
D. 1,65 g.
6.60. Để khử hoàn toàn m gam hỗn hợp CuO và PbO cần 8,1 g kim loại nhôm sau phản ứng thu được 50,2 g hỗn hợp 2 kim loại. Giá trị của m là
A. 57,4.
B. 54,4.
C. 53,4.
D. 56,4.
6.61. Cho 16,2 g kim loại X (có hoá trị n duy nhất) tác dụng với 3,36 lít O2 (đktc), phản ứng xong thu được chất rắn A. Cho A tác dụng hết với đung dịch HCl thấy có 1,2 g khí H2 thoát ra. Kim loại X là
A. Mg.
B. Zn.
C. Al.
D. Ca.
Hướng dẫn trả lời:
6.55. B
6.56. C
6.57. A
6.58. C
6.59. A
6.60. A
6.61. C
Bài 6.62, 6.63 trang 64 sách bài tập (SBT) Hóa học 12
6.62. Khi cho m gam Al tác dụng với dung dịch NaOH dư được X lít khí và khi cho cũng m gam Al tác dụng với HNO3 loãng dư được y lít khí N2 duy nhất (các thể tích khí đo ở cùng điều kiện). Quan hệ giữa x và y là
A. x = 5y.
B. y = 5x.
C. x = y.
D. x= 2,5y.
6.63. Nhận định nào sau đây không đúng?
A. Trong phản ứng của Al với dung dịch NaOH thì Al là chất khử và NaOH là chất oxi hoá.
B. Al có khả năng tác dụng với nước ngay ở điều kiện thường.
C. Al là kim loại có tính khử mạnh, nó bị oxi hoá dễ dàng thành ion Al3+.
D. Hỗn hợp gồm bột nhôm và bột oxit sắt từ được gọi là hỗn hợp tecmit.
Hướng dẫn trả lời:
6.62. A
6.63. A
6.62. Chọn A
![]() \(Al\buildrel { + NaOH} \over\longrightarrow {3 \over 2}{H_2}\,\,\,\,\) và
\(Al\buildrel { + NaOH} \over\longrightarrow {3 \over 2}{H_2}\,\,\,\,\) và ![]() \(10{\rm{A}}l\buildrel { + HN{O_3}} \over\longrightarrow 3{N_2}\)
\(10{\rm{A}}l\buildrel { + HN{O_3}} \over\longrightarrow 3{N_2}\)
Ta có: ![]() \({n_{{H_2}}} = {m \over {27}}.{3 \over 2} = {x \over {22,4}}\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\left( 1 \right)\)
\({n_{{H_2}}} = {m \over {27}}.{3 \over 2} = {x \over {22,4}}\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\left( 1 \right)\)
Và ![]() \({n_{{N_2}}} = {m \over {27}}.{3 \over {10}} = {y \over {22,4}}\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\left( 2 \right)\)
\({n_{{N_2}}} = {m \over {27}}.{3 \over {10}} = {y \over {22,4}}\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\left( 2 \right)\)
Từ (1) và (2)![]() \(\Rightarrow {x \over y} = 5\)
\(\Rightarrow {x \over y} = 5\)
6.63. Chọn A
Trong phản ứng giữa Al với dung dịch NaOH, chất đóng vai trò oxi hóa là H2O không phải NaOH
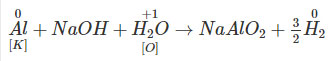
Bài 6.64 trang 64 sách bài tập (SBT) Hóa học 12
Quặng boxit chứa Al2O3.2H2O thường có lẫn tạp chất là Fe2O3 và SiO2. Để tinh chế quặng, người ta làm như sau: Cho quặng tác dụng với NaOH đặc, dư. Lọc bỏ chất rắn không tan được dung dịch X. Sục CO2 dư vào dung dịch X được kết tủa Y và dung dịch Z. Nung kết tủa Y ở nhiệt độ cao được A12O3 tinh khiết. Hãy lập sơ đồ biến đổi của các chất trong quá trình tinh chế trên.
Hướng dẫn trả lời:
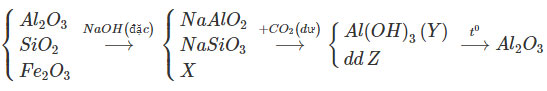
Bài 6.65 trang 64 sách bài tập (SBT) Hóa học 12
Tại sao Al khử H2O rất chậm và khó, nhưng lại khử H2O dễ dàng trong dung dịch kiềm mạnh, giải phóng khí H2? Kiềm giữ vai trò gì trong phản ứng này? Viết phương trình hoá học của các phản ứng.
Hướng dẫn trả lời:
Al khử H2O rất khó khăn, không thu được khí H2 vì Al phản ứng với nước tạo ra màng bảo vệ là Al(OH)3, nó ngăn không cho Al tiếp xúc với nước. Trong dung dịch kiềm mạnh (NaOH, KOH,...) màng bảo vệ Al(OH)3 sinh ra liền bị phá huỷ, do đó Al khử H2O dễ dàng, giải phóng khí H2.
2Al + 6H2O→ 2Al(OH)3+ 3H2 (1)
Al(OH)3 + NaOH → NaAlO2 +2H2O (2)
Hai phản ứng trên xảy ra luân phiên nhau, cho tới khi Al bị oxi hoá hết. Ở đây, kiềm giữ vai trò hoà tan màng bảo vệ Al(OH)3, tạo điều kiện cho Al khử H2O dễ dàng.
Bài 6.66 trang 64 sách bài tập (SBT) Hóa học 12
Có gì giống nhau và khác nhau khi nhỏ từ từ cho đến dư:
a) Dung dịch NH3 vào dung dịch AlCl3?
b) Dung dịch Ba(OH)2 vào dung dịch AlCl3?
Hướng dẫn trả lời:
a) Kết tủa tạo ra không tan trong dung dịch NH3 dư:
AlCl3 + 3NH3 + 3H2O → Al(OH)3 + 3NH4Cl
b) Kết tủa tạo ra tan trong dung dịch Ba(OH)2 dư:
2AlCl3 + 3Ba(OH)2 → 2Al(OH)3 + 3BaCl2
2Al(OH)3 + Ba(OH)2 → Ba(AlO2)2 + 4H2O.
Bài 6.67 trang 64 sách bài tập (SBT) Hóa học 12
Tuỳ thuộc vào nồng độ của dung dịch HNO3, Al có thể khử HNO3 thành NO2, N2O, NO, N2, NH4NO3. Viết phương trình hoá học của các phản ứng
Hướng dẫn trả lời:
Các phương trình hoá học:
Al + 6HNO3→ Al(NO3)3 + 3NO2 + 3H2O
Al + 4HNO3 → Al(NO3)3 + NO + 2H2O
8Al + 30HNO3 → 8Al(NO3)3 + 3N2O + 15H2O
10Al + 36HNO3 → 10Al(NO3)3 + 3N2 + 18H2O
8Al + 30HNO3 →8Al(NO3)3 + 3NH4NO3 + 9H2O.
Bài 6.68 trang 64 sách bài tập (SBT) Hóa học 12
Có 4 kim loại riêng biệt là Na, Ca, Cu, Al. Hãy nhận biết mỗi kim loại bằng phương pháp hoá học và viết các phương trình hoá học.
Hướng dẫn trả lời:
Dùng H2O để phân thành 2 nhóm kim loại: Nhóm (1) gồm Na và Ca, nhóm (2) gồm Cu và Al. Sản phẩm là các dung dịch NaOH và Ca(OH)2.
Dùng CO2 nhận biết dung dịch Ca(OH)2, suy ra chất ban đầu là Ca. Kim loại còn lại ở nhóm (1) là Na.
Kim loại nào ở nhóm (2) tác dụng với dung dịch NaOH tạo bọt khí, kim loại đó là Al. Kim loại còn lại ở nhóm (2) là Cu.
Bài 6.69 trang 65 sách bài tập (SBT) Hóa học 12
Chỉ dùng những chất ban đầu là NaCl, H2O, Al hãy điều chế:
a) AlCl3.
b) Al(OH)3.
c) Dung dịch NaAlO2
Hướng dẫn trả lời:
a) Hoà tan NaCl vào nước tới bão hoà rồi điện phân dung dịch:
![]()
Thu Cl2 cho phản ứng với Al:
2Al + 3Cl2→2AlCl3 (2)
- Lấy AlCl3 vừa điều chế được (2) cho tác dụng với NaOH ở (1):
AlCl3 + 3NaOH (vừa đủ) →Al(OH)3 + 3NaCl (3)
- Lấy Al(OH)3 điều chế được ở (3) cho tác dụng với NaOH:
Al(OH)3 + NaOH → NaAlO2 + 2H2O
Bài 6.70 trang 65 sách bài tập (SBT) Hóa học 12
Có gì giống và khác nhau khi cho khí CO2 và dung dịch HCl loãng tác dụng với dung dịch NaAlO2? Viết phương trình hoá học của các phản ứng xảy ra.
Hướng dẫn trả lời:
- Kết tủa xuất hiện, không tan trong CO2 dư:
NaAlO2 + CO2 + 2H2O → Al(OH)3 + NaHCO3
- Kết tủa xuất hiện rồi tan trong dung dịch HCl dư:
NaAlO2 + HCl + H2O → Al(OH)3 + NaCl
Al(OH)3 + 3HCl → AlCl3 + 3H2O.
Bài 6.71 trang 65 sách bài tập (SBT) Hóa học 12
Cho 13,5 g Al vào dung dịch NaOH nóng, lấy dư.
a) Viết phương trình hoá học của phản ứng dưới dạng phân tử và ion thu gọn.
b) Tính thể tích khí H2 bay ra ở 735 mmHg và 22,5°C.
Hướng dẫn trả lời:
a) 2Al + 2NaOH + 2H2O→ 2NaAlO2 + 3H2
natri aluminat
2Al + 2OH- + 2H2O → 2AlO2 - + 3H2
ion aluminat
b) ![]() \({n_{Al}} = {{13,5} \over {27}} = 0,5mol\)
\({n_{Al}} = {{13,5} \over {27}} = 0,5mol\)
![]() \({n_{{H_2}}} = {3 \over 2}.{n_{Al}} = 0,75mol\)
\({n_{{H_2}}} = {3 \over 2}.{n_{Al}} = 0,75mol\)
![]() \(\to {V_{{H_2}}} = {{nRT} \over P} = {{0,75.0,082.(22,5 + 273).760} \over {735}} = 18,8l\)
\(\to {V_{{H_2}}} = {{nRT} \over P} = {{0,75.0,082.(22,5 + 273).760} \over {735}} = 18,8l\)
Bài 6.72 trang 65 sách bài tập (SBT) Hóa học 12
Hoà tan 0,12 mol FeCl3, 0,15 mol MgS04 và 0,16 mol A12(S04)3 vào dung dịch chứa 0,4 moi H2SO4 và 0,1 mol HCl được dung dịch X. Cho 254 ml dung dịch NaOH 10M vào X được m gam kết tủa. Xác định giá trị của m.
Hướng dẫn trả lời:
n Fe3+ = 0,12 mol n Mg2+ = 0,15 mol n Al3+ = 0,32 mol
n H+ =0,9 mol n OH- = 2,54 mol
Khi cho NaOH vào dd X thì:
(1) H+ + OH- → H2O
→ n OH- = n H+ = 0,9mol
(2) Fe3+ + 3OH- → Fe(OH)3↓
→ n OH- = 3n Fe3+ = 3.0,12= 0,36mol
(3) Mg2+ + 2OH- → Mg(OH)2 ↓
→ n OH- = 2 n Mg2+ = 2.0,15=0,3mol
Từ (1),(2) và (3) → n OH- (dư) =2,54- 0,9- 0,36- 0,3= 0,98 mol
(4) Al3+ + 3OH- → Al(OH)3↓
→ n OH- = 3n Al3+ = 3.0,32=0,96 mol
Do OH- dư 0,02 mol nên tiếp tục có pứ:
(5) Al(OH)3 + OH- → AlO2- + 2H2O
→ n Al(OH)3 = 0,32 -0,02= 0,3 mol
Vậy kết tủa gồm Fe(OH)3: 0,12 mol, Mg(OH)2: 0,15 mol, Al(OH)3: 0,3 mol
→ m ↓= 0,12.107+ 0,15.58+ 0,3.78 = 44,94g
Bài 6.73 trang 65 sách bài tập (SBT) Hóa học 12
Cho 100 ml dung dịch NaOH X mol/1 (x > 0,4M) vào dung dịch chứa 0,02 mol MgCl2 và 0,02 mol AlCl3. Lọc lấy kết tủa và nung đến khối lượng không đổi được m gam chất rắn. Để m nhỏ nhất thì giá trị của X bằng bao nhiêu.
Hường dẫn trả lời:
MgCl2 + 2NaOH → Mg(OH)2↓ + 2NaCl
Al(OH)3 + 3NaOH → Al(OH)3↓ + 3NaCl
NaOH + Al(OH)3 → NaAlO2 + 2H2O
Kết tủa nhỏ nhất khi Al(OH)3 tan hết
→ nNaOH= 2n MgCl2 + 3n AlCl3 + n Al(OH)3
= 2.0,02 + 3.0,02 + 0,02= 0,12 mol
Vậy ![]() \(x = {{0,12} \over {0,1}} = 1,2M\)
\(x = {{0,12} \over {0,1}} = 1,2M\)
----------------------------------
Để có kết quả cao hơn trong học tập, VnDoc xin giới thiệu tới các bạn học sinh tài liệu Giải bài tập Toán lớp 12, Giải bài tập Hóa học lớp 12, Giải bài tập Vật Lí 12 mà VnDoc tổng hợp và đăng tải.


