Tính acid của nitric acid
Dung dịch nitric acid thể hiện tính acid khi tác dụng với?
Dung dịch nitric acid thể hiện tính acid khi tác dụng với dung dịch NaOH
Phương trình phản ứng:
NaOH + HNO3 → NaNO3 + H2O
Cùng nhau làm bài kiểm tra khảo sát chất lượng môn Hóa 11 sách Kết nối tri thức nha!
Tính acid của nitric acid
Dung dịch nitric acid thể hiện tính acid khi tác dụng với?
Dung dịch nitric acid thể hiện tính acid khi tác dụng với dung dịch NaOH
Phương trình phản ứng:
NaOH + HNO3 → NaNO3 + H2O
Chất không điện li
Chất nào sau đây là chất không điện li
Dung dịch hữu cơ C2H5OH không phân li ra ion nên không phải là chất điện li
Hiện tượng phú dưỡng
Phú dưỡng là hệ quả sau khi ao ngòi, sông hồ nhận quá nhiều các nguồn thải chứa các chất dinh dưỡng chứa nguyên tố nào sau đây:
Sự dư thừa dinh dưỡng chủ yếu do hàm lượng các ion nitrate, phosphate vượt quá mức cho phép sẽ gây nên hiện tượng phú dưỡng.
Cặp chất là đồng đẳng của nhau
Cặp chất nào sau đây là đồng đẳng của nhau?
Các chất hữu cơ có tính chất hoá học tương tự nhau và thành phần phân tử hơn kém nhau một hay nhiều nhóm CH2 được gọi là các chất đồng đẳng của nhau, chúng hợp thành một dãy đồng đẳng.
Vậy cặp chất HCOOH, CH3COOH là đồng đẳng của nhau
Muối bị nhiệt phân thu được khí và hơi nước
Nhiệt phân hoàn toàn muối nào sau đây thu được sản phẩm gồm khí và hơi nước:
Muối bị nhiệt phân hoàn toàn thu được sản phẩm chỉ gồm khí và hơi là (NH4)2CO3
(NH4)2CO3 2NH3 + CO2 + H2O
Tổng hệ số tối giản
Tổng hệ số tối giản trong cân bằng phản ứng: Fe + HNO3 → Fe(NO3)3 + N2O + H2O?
Xác định sự thay đổi số oxi hóa
Quá trình oxi hoá, quá trình khử
8 x 3x | Fe0 → Fe+3 + 3e 2N+5 + 8e → 2N+1 |
Cân bằng phương trình:
8Fe + 30HNO3 → 8Fe(NO3)3 + 3N2O + 15H2O
Tổng hệ số cân bằng tối giản là: 8 + 30 + 8 + 3 + 15 = 64
Hợp chất hữu cơ
Hợp chất nào sau đây là hợp chất hữu cơ?
Hợp chất của carbon là hợp chất hữu cơ (trừ một số hợp chất như carbon monoxide, carbon dioxide, muối carbonate, cyanide, carbide....).
Vậy hợp chất hữu cơ là CH3CH3
Xác định kim loại phản ứng H2SO4 loãng nhưng không tác dụng H2SO4 đặc nguội
Kim loại nào sau đây tan trong dung dịch H2SO4 loãng, nhưng không tan được trong dung dịch H2SO4 đặc, nguội?
Fe tan trong dung dịch H2SO4 loãng, nhưng không không tan được trong dung dịch H2SO4 đặc, nguội
Tách các chất lỏng ra khỏi hỗn hợp
Để tách các chất lỏng ra khỏi hỗn hợp các chất có nhiệt độ khác nhau, nhằm thu được chất lỏng tinh khiết hơn dùng phương pháp nào sau đây?
Để tách các chất lỏng ra khỏi hỗn hợp các chất có nhiệt độ sôi khác nhau, nhằm thu được chất lỏng tinh khiết hơn là phương pháp chưng cất.
Phản ứng chứng tỏ sulfur có tính oxi hóa
Phản ứng nào sau đây chứng tỏ sulfur có tính oxi hóa
(1)
(2)
(3)
(4)
Trong các phản ứng trên, các phản ứng trong đó S thể hiện tính khử (số oxi hóa tăng): (1), (2), (4).
Còn (3) S thể hiện tính oxi hóa (số oxi hóa giảm)
Phản ứng tổng hợp ammonia từ nitrogen và hydrogen
Trong phản ứng tổng hợp ammonia từ nitrogen và hydrogen, nitrogen đóng vai trò là:
Phương trình hoá học tổng hợp ammonia: N2 + 3H2 ⇌ 2NH3.
Trước phản ứng, N2 có số oxi hoá là 0. Sau phản ứng trong hợp chất NH3 nguyên tử có số oxi hoá là −3. Vậy số oxi hoá của N giảm nên N2 có vai trò là chất oxi hoá.
Cặp acid - base liên hợp
Cho phản ứng: H2SO4(aq) + H2O(aq) HSO4- (aq) + H3O+ (aq)
Cặp acid - base liên hợp trong phản ứng trên là:
Trong phản ứng trên H2SO4 nhường H+ để tạo thành HSO4-, H3O+ nhường H+ để tạo thành H2O.
Nhận biết KOH, NH4Cl, K2SO4, (NH4)2SO4
Để nhận biết 4 dung dịch đựng trong 4 lọ mất nhãn là KOH, NH4Cl, K2SO4, (NH4)2SO4, ta có thể chỉ dùng một thuốc thử nào trong số các thuốc thử sau:
Để nhận biết 4 dung dịch trên ta sử dụng thuốc thử là dung dịch Ba(OH)2
Trích mẫu thử và đánh số thứ tự
Ống nghiệm nào xuất hiện kết tủa trắng → K2SO4
Ba(OH)2 + K2SO4 → 2KOH + BaSO4 ↓
Ống nghiệm vừa xuất hiện kết tủa trắng và có khí không màu mùi khai
(NH4)2SO4 + Ba(OH)2 → BaSO4↓ + 2NH3↑ + 2H2O
Ống nghiệm có khí không màu, mùi khai → NH4Cl
Ba(OH)2 + 2NH4Cl → BaCl2 + 2NH3 ↑ + 2H2O
Ống nghiệm không có hiện tượng gì là KCl
Xác định chất tương ứng
Cho phổ hồng ngoại (IR) của chất hữu cơ như hình dưới tương ứng chất nào sau đây?
Hợp chất hữu cơ có vùng tín hiệu ở 3281 cm-1 và 2986 cm-1 là tín hiệu đặc trưng của nhóm carboxylic acid (-COOH)
Xác định chất X
Khí X làm đục nước vôi trong và được dùng làm chất tẩy trắng bột gỗ trong công nghiệp giấy. Chất X là
Cả SO2 và CO2 đều làm đục nước vôi trong nhưng chỉ có SO2 có thể tẩy trắng được bột gỗ trong công nghiệp giấy
Xác định khí sinh ra
Người ta nung nóng copper với dung dịch H2SO4 đặc nóng. Khí sinh ra có tên gọi:
Phương trình phản ứng
Cu + 2H2SO4 → CuSO4+ SO2↑ + 2H2O
Khí sinh ra chính là khí sulfur dioxide
Xác định chất X, Y
Khi trộn khí X và khí Y thì thấy xuất hiện khói trắng. Các khí X và Y có thể là các là các khí nào sau đây?
Khi trộn khí NH3 với khí HCl thì xuất hiện “khói” trắng.
Phương trình phản ứng minh họa
NH3 + HCl → NH4Cl
Cấu thức cấu tạo không phải của C3H8O
Công thức cấu tạo không phải của C3H8O là?
CH3-CH2-OH-CH2 không phải là công thức cấu tạo của C3H8O vì trong hợp chất hữu cơ Oxygen chỉ có hóa trị II, không có hóa trị III.
Trong mỗi ý a), b), c), d) ở mỗi câu hỏi, chọn Đúng hoặc Sai.
Phân tử ammonia được tạo bởi một nguyên tử nitrogen liên kết với ba nguyên tử hydrogen và có dạng hình học là chóp tam giác.
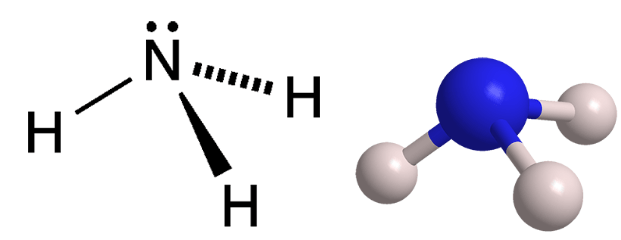
a) Phân tử amonia có độ bền nhiệt cao. Sai||Đúng
b) Ammonia thể hiện tính base yếu do một phần nhỏ các phân tử NH3 kết hợp với ion H+ của nước tạo NH4+ và OH-. Đúng||Sai
c) Để làm khô khí NH3 có lẫn hơi nước, có thể dẫn khí NH3 đi qua bình đựng dung dịch H2SO4 đặc. Sai||Đúng
d) Tã lót trẻ em sau khi được giặt sạch vẫn còn mùi khai do vẫn lưu lại một lượng ammonia. Để khử hoàn toàn mùi của ammonia thì người ta cho vào nước xả cuối cùng một ít giấm ăn. Đúng||Sai
Phân tử ammonia được tạo bởi một nguyên tử nitrogen liên kết với ba nguyên tử hydrogen và có dạng hình học là chóp tam giác.

a) Phân tử amonia có độ bền nhiệt cao. Sai||Đúng
b) Ammonia thể hiện tính base yếu do một phần nhỏ các phân tử NH3 kết hợp với ion H+ của nước tạo NH4+ và OH-. Đúng||Sai
c) Để làm khô khí NH3 có lẫn hơi nước, có thể dẫn khí NH3 đi qua bình đựng dung dịch H2SO4 đặc. Sai||Đúng
d) Tã lót trẻ em sau khi được giặt sạch vẫn còn mùi khai do vẫn lưu lại một lượng ammonia. Để khử hoàn toàn mùi của ammonia thì người ta cho vào nước xả cuối cùng một ít giấm ăn. Đúng||Sai
a. Sai vì
Do có năng lượng liên kết nhỏ nên phân tử ammonia có độ bền nhiệt rất thấp.
b. Đúng
c. Sai vì
NH3 phản ứng với H2SO4 đặc, do đó không sử dụng dung dịch H2SO4 đặc để làm khô khí NH3.
d. Đúng
Trong mỗi ý a), b), c), d) ở mỗi câu hỏi, chọn Đúng hoặc Sai.
Nhiều hộ gia đình thường trữ một số hoá chất như baking soda, thạch cao nung và phèn chua (hay phèn nhôm kali).
a) Thạch cao nung có công thức hóa học CaSO4.2H2O. Sai||Đúng
b) Phèn chua được sử dụng để làm trong nước tạo môi trường acid nhẹ.Đúng||Sai
c) Có thể dùng nước và quỳ tím để phân biệt các mẫu bột mịn của ba chất trên. Đúng||Sai
d) Baking soda phản ứng với giấm ăn giúp đánh bay vết ố, mảng bám trên đồ gia dụng. Đúng||Sai
Nhiều hộ gia đình thường trữ một số hoá chất như baking soda, thạch cao nung và phèn chua (hay phèn nhôm kali).
a) Thạch cao nung có công thức hóa học CaSO4.2H2O. Sai||Đúng
b) Phèn chua được sử dụng để làm trong nước tạo môi trường acid nhẹ.Đúng||Sai
c) Có thể dùng nước và quỳ tím để phân biệt các mẫu bột mịn của ba chất trên. Đúng||Sai
d) Baking soda phản ứng với giấm ăn giúp đánh bay vết ố, mảng bám trên đồ gia dụng. Đúng||Sai
a) Sai vì
Thạch cao nung: CaSO4.H2O hoặc CaSO4.0,5H2O.
b) đúng
c) đúng
Dùng nước hoà tan các mẫu bột mịn tạo thành dung dịch, thạch cao nung tan khá ít. Có thể dùng quỳ tím để nhận biết nhanh hơn hai dung dịch còn lại, dung dịch làm quỳ hoá xanh là baking soda, hoá đỏ là phèn nhôm kali. Do dung dịch baking soda có quá trình:
(aq) + H2O(l) ⇌ H2CO3(aq) + OH−(aq)
Và dung dịch phèn nhôm kali tạo môi trường acid
d) đúng
Trong mỗi ý a), b), c), d) ở mỗi câu hỏi, chọn Đúng hoặc Sai.
Thêm hexane (một hydrocarbon trong phân tử có 6 nguyên tử carbon) vào dung dịch iodine trong nước, lắc đều rồi để yên. Sau đó thu lấy lớp hữu cơ, làm bay hơi dung môi để thu lấy iodine.
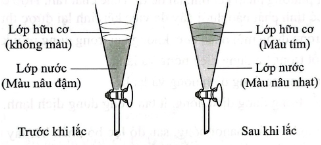
a) Người ta sử dụng phương pháp chiết lỏng – rắn để thu lấy iodine từ dung dịch iodine trong nước. Sai||Đúng
b) Dụng cụ sử dụng là bình tam giác có nút. Sai||Đúng
c) Để tách riêng phần nước và phần hữu cơ ta mở khóa phễu chiết, phần nước ở dưới sẽ thoát ra, lần lượt thu lấy phần nước và phần hữu cơ riêng biệt. Đúng||Sai
d) Sự khác nhau về màu sắc của lớp nước và lớp hữu cơ trong dụng cụ trước và sau khi lắc là do iodine tan tốt trong hexane hơn, nên ở lớp hữu cơ nồng độ iodine cao hơn và tạo thành dung dịch có màu tím. Đúng||Sai
Thêm hexane (một hydrocarbon trong phân tử có 6 nguyên tử carbon) vào dung dịch iodine trong nước, lắc đều rồi để yên. Sau đó thu lấy lớp hữu cơ, làm bay hơi dung môi để thu lấy iodine.

a) Người ta sử dụng phương pháp chiết lỏng – rắn để thu lấy iodine từ dung dịch iodine trong nước. Sai||Đúng
b) Dụng cụ sử dụng là bình tam giác có nút. Sai||Đúng
c) Để tách riêng phần nước và phần hữu cơ ta mở khóa phễu chiết, phần nước ở dưới sẽ thoát ra, lần lượt thu lấy phần nước và phần hữu cơ riêng biệt. Đúng||Sai
d) Sự khác nhau về màu sắc của lớp nước và lớp hữu cơ trong dụng cụ trước và sau khi lắc là do iodine tan tốt trong hexane hơn, nên ở lớp hữu cơ nồng độ iodine cao hơn và tạo thành dung dịch có màu tím. Đúng||Sai
a) Sai vì
Người ta sử dụng phương pháp chiết lỏng – lỏng để thu lấy iodine từ dung dịch iodine trong nước.
b) Sai vì
Dụng cụ sử dụng là phễu chiết.
c) Đúng
d) Đúng
Trong mỗi ý a), b), c), d) ở mỗi câu hỏi, chọn Đúng hoặc Sai.
Cho ba dung dịch có cùng nồng độ: hydrochloric acid (HCl), ethanoic acid (acetic acid, CH3COOH) và sodium hydroxide (NaOH). Khi chuẩn độ riêng một thể tích như nhau của dung dịch HCl và dung dịch CH3COOH bằng dung dịch NaOH.
a) Trước khi chuẩn độ, pH của hai acid bằng nhau. Sai||Đúng
b) Tại các điểm tương đương, dung dịch của cả hai phép chuẩn độ đều có giá trị pH bằng 7. Sai||Đúng
c) Cần cùng một thể tích sodium hydroxide để đạt đến điểm tương đương. Đúng||Sai
d) Giá trị pH của hai acid tăng như nhau cho đến khi đạt điểm tương đương. Sai||Đúng
Cho ba dung dịch có cùng nồng độ: hydrochloric acid (HCl), ethanoic acid (acetic acid, CH3COOH) và sodium hydroxide (NaOH). Khi chuẩn độ riêng một thể tích như nhau của dung dịch HCl và dung dịch CH3COOH bằng dung dịch NaOH.
a) Trước khi chuẩn độ, pH của hai acid bằng nhau. Sai||Đúng
b) Tại các điểm tương đương, dung dịch của cả hai phép chuẩn độ đều có giá trị pH bằng 7. Sai||Đúng
c) Cần cùng một thể tích sodium hydroxide để đạt đến điểm tương đương. Đúng||Sai
d) Giá trị pH của hai acid tăng như nhau cho đến khi đạt điểm tương đương. Sai||Đúng
HCl là acid mạnh phân li hoàn toàn ra ion H+ và Cl-. CH3COOH là acid yếu sẽ phân li không hoàn toàn
a) Sai
vì CH3COOH là acid yếu, HCl là acid mạnh ⇒ nên pH của dung dịch CH3COOH lớn hơn pH của HCl acid mạnh
b) Sai.
Vì tại các điểm tương đương acid phản ứng hết thu được dung dịch
CH3COONa có pH > 7
NaCl có pH = 7
c) Đúng.
Cả hydrochloric acid và ethanoic acid (acetic acid) đều là acid đơn chức nên khi các thể tích và nồng độ bằng nhau của các acid này được chuẩn độ bằng sodium hydroxide thì cần cùng một thể tích base để đạt đến điểm tương đương.
d) Sai.
Vì giá trị pH của acid CH3COOH sẽ tăng nhanh hơn giá trị pH của acid HCl
Điền đáp án vào chỗ trống
Cho các chất sau: CH3-CH2-CH3, CH3-NH2, CH2=CH-CH3, CH2=CH-COOH, CH2=CH-CH=CH2, CH3OH, CH≡CH, C6H5OH, HCHO, CH3COOCH3, H2N-CH2-COOH. Số chất là dẫn xuất của hydrocarbon?
Cho các chất sau: CH3-CH2-CH3, CH3-NH2, CH2=CH-CH3, CH2=CH-COOH, CH2=CH-CH=CH2, CH3OH, CH≡CH, C6H5OH, HCHO, CH3COOCH3, H2N-CH2-COOH. Số chất là dẫn xuất của hydrocarbon?
Dẫn xuất hydrocarbon là những hợp chất mà trong phân tử ngoài chứa C, H còn có các nguyên tố khác như O, N, S, halogen,...
CH3-NH2, CH2=CH-COOH, CH3OH, C6H5OH, HCHO, CH3COOCH3, H2N-CH2-COOH.
Điền đáp án vào chỗ trống
Cho dung dịch sulfuric acid đặc tác dụng với từng chất rắn sau: Cu, NaOH, NaBr, Fe2O3, NaHCO3 ở nhiệt độ thường. Số phản ứng trong đó sulfuric acid đóng vai trò chất oxi hoá là?
Cho dung dịch sulfuric acid đặc tác dụng với từng chất rắn sau: Cu, NaOH, NaBr, Fe2O3, NaHCO3 ở nhiệt độ thường. Số phản ứng trong đó sulfuric acid đóng vai trò chất oxi hoá là?
Phương trình phản ứng
2H2SO4 + 2NaBr → Na2SO4 + Br2 + SO2 + 2H2O
Cu + 2H2SO4 → CuSO4+ SO2↑ + 2H2O
Fe2O3 + 3H2SO4 → Fe2(SO4)3 + 3H2O
2NaOH + H2SO4 → Na2SO4 + 2H2O
2NaHCO3 + H2SO4 → Na2SO4 + 2CO2 ↑ + 2H2O
Vậy H2SO4 đặc tác dụng với NaBr và Cu đóng vai trò là chất oxi hóa
Điền đáp án vào chỗ trống
Một nhà máy luyện kim, ở giai đoạn đầu của quá trình sản xuất Zn từ quặng blend thu được sản phẩm phụ là SO2 theo so đồ phản ứng:
ZnS + O2 → ZnO + SO2
Đốt cháy 1 tấn quặng blend (chứa 77,6% khối lượng ZnS) bằng không khí, thu được tối đa V m3 khí SO2 (đkc). Xác định giá trị V?
Một nhà máy luyện kim, ở giai đoạn đầu của quá trình sản xuất Zn từ quặng blend thu được sản phẩm phụ là SO2 theo so đồ phản ứng:
ZnS + O2 → ZnO + SO2
Đốt cháy 1 tấn quặng blend (chứa 77,6% khối lượng ZnS) bằng không khí, thu được tối đa V m3 khí SO2 (đkc). Xác định giá trị V?
Phương trình phản ứng
2ZnS + 3O2 2ZnO + 2SO2
Khối lượng gam ZnS là:
Dựa vào phương trình phản ứng ta có:
nSO2 = nZnS = 8000 (mol)
Thể tích khí SO2 là:
VSO2 = 8000 . 24,79 = 198320 L = 198,32 m3
Điền đáp án vào chỗ trống
Cho bảng giá trị năng lượng của một số liên kết ở điều kiện chuẩn sau:
Liên kết | H−H | N−H | N≡N |
Năng lượng liên kết (kJ mol–1) | 436 | 389 | 946 |
Tính giá trị biến thiên enthalpy chuẩn của phản ứng sau theo năng lượng liên kết:
N2(g) + 3H2(g) ⇌ 2NH3(g)
Cho bảng giá trị năng lượng của một số liên kết ở điều kiện chuẩn sau:
Liên kết | H−H | N−H | N≡N |
Năng lượng liên kết (kJ mol–1) | 436 | 389 | 946 |
Tính giá trị biến thiên enthalpy chuẩn của phản ứng sau theo năng lượng liên kết:
N2(g) + 3H2(g) ⇌ 2NH3(g)
N2(g) + 3H2(g) ⇌ 2NH3(g)
Biến thiên enthalpy chuẩn của phản ứng trên được tính theo năng lượng liên kết là
ΔrH o298 = ∑Eb (cđ ) − ∑Eb(sp) = Eb(N≡N) + 3.Eb(H-H) -2.3. Eb(N-H)
ΔrH o298 = 1.946 + 3.436 - 6.389 = -80 (kJ).
Điền đáp án vào chỗ trống
Trộn lẫn V mL dung dịch NaOH 0,01 M với V mL dung dịch HCl 0,03 M thu được 2V mL dung dịch Y. Tính pH của dung dịch Y.
Trộn lẫn V mL dung dịch NaOH 0,01 M với V mL dung dịch HCl 0,03 M thu được 2V mL dung dịch Y. Tính pH của dung dịch Y.
nNaOH = 0,01V (mol)
nHCl = 0,03V (mol)
Phản ứng:
HCl + NaOH → NaCl + H2O
0,03 V 0,01V
Xét tỉ lệ mol
⇒ NaOH hết, HCl dư
⇒ nHCl dư = 0,03V – 0,01V = 0,02V (mol)
HCl → H+ + Cl-
0,01 → 0,01 M
⇒ [H+] = 0,01 M ⇒ pH = -log(10-2) = 2.
Điền đáp án vào chỗ trống
Chất hữu cơ X được sử dụng khá rộng rãi trong ngành y tế với tác dụng chống vi khuẩn, vi sinh vật. Kết quả phân tích của nguyên tố X như sau: 52,17% C; 13,04% H về khối lượng, còn lại là oxygen. Phân tử khối của X được xác định thông qua kết quả phổ khối lượng với peak ion phân tử có giá trị m/z lớn nhất bằng 46. Dựa vào phổ IR dưới đây, xác định công thức cấu tạo của X?
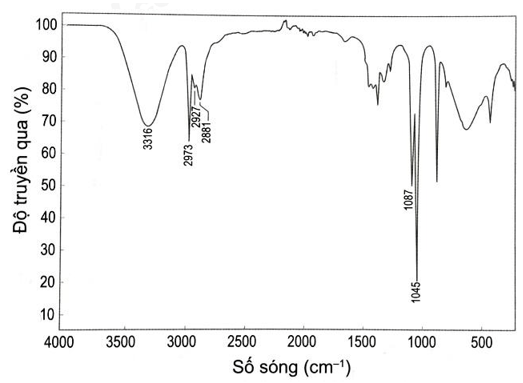
Chất hữu cơ X được sử dụng khá rộng rãi trong ngành y tế với tác dụng chống vi khuẩn, vi sinh vật. Kết quả phân tích của nguyên tố X như sau: 52,17% C; 13,04% H về khối lượng, còn lại là oxygen. Phân tử khối của X được xác định thông qua kết quả phổ khối lượng với peak ion phân tử có giá trị m/z lớn nhất bằng 46. Dựa vào phổ IR dưới đây, xác định công thức cấu tạo của X?

%mO = 100% - 52,17% - 13,04% = 34,79%.
Đặt công thức phân tử của X là: CxHyOz.
Từ phổ khối lượng của X xác định được MX = 46.
Ta có:
Công thức phân tử của X là: C2H6O.
Vùng tín hiệu đặc trưng của nhóm –OH là: 3650 – 3200 cm-1
Dựa vào phổ hồng ngoại IR ta thấy nhóm –OH có tín hiệu ở vùng 3316 cm-1
Vậy công thức cấu tạo của C2H6O
CH3-CH2-OH
Theo Nghị định 147/2024/ND-CP, bạn cần xác thực tài khoản trước khi sử dụng tính năng này. Chúng tôi sẽ gửi mã xác thực qua SMS hoặc Zalo tới số điện thoại mà bạn nhập dưới đây:
