Tên gọi của hợp chất
Cho chất sau:
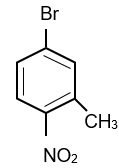
Tên gọi của hợp chất theo danh pháp thay thế là
Đánh số trên vòng sao cho tổng vị trí trên vòng là nhỏ nhất:

⇒ Tên gọi của hợp chất là: 4-bromo-2-methyl-1-nitrobenzene.
Đề kiểm tra 15 phút Hóa 11 Chương 4 Hydrocarbon sách Kết nối tri thức giúp bạn học tổng hợp lại kiến thức của cả nội dung chương. Cùng nhau luyện tập nha!
Tên gọi của hợp chất
Cho chất sau:

Tên gọi của hợp chất theo danh pháp thay thế là
Đánh số trên vòng sao cho tổng vị trí trên vòng là nhỏ nhất:

⇒ Tên gọi của hợp chất là: 4-bromo-2-methyl-1-nitrobenzene.
Tính khối lượng Br2
Đốt cháy hoàn toàn 0,32 mol hỗn hợp X gồm CH4, C2H2, C2H4 và C3H6, sau đó dẫn sản phẩm cháy đi qua bình đựng nước vôi trong dư thấy xuất hiện 24 gam kết tủa, đồng thời thấy khối lượng dung dịch tăng 12,88 gam, lọc kết tủa đun nóng phần nước lọc thu được 16 gam kết tủa nữa . Mặt khác 20,2 gam X phản ứng tối đa với a mol Br2 trong dung dịch. Giá trị của a là
Tóm tắt đề bài qua sơ đồ sau:
Áp dụng bảo toàn nguyên tố C ta có:
nCO2 = nCaCO3 = 0,24 + 0,16.2 = 0,56 mol
m dung dịch tăng = (mCO2 + mH2O) - mCaCO3
⇒ mH2O = 12,88 + 24 - 0,56.44 = 12,24 gam
⇒ nH2O = 12,24:18 = 0,68 mol
Ta có:
nCO2 - nH2O = (k-1).nX
⇒ 0,56 - 0,68 = (k-1).0,32
-0,12 = 0,32k - 0,32
⇒ k = 0,625
0,32 mol X có khối lượng là: 0,56.12 + 0,68.2 = 8,08 gam
Vậy 20,2 gam X có số mol là:
20,2.0,32:8,08 = 0,8 mol
Vậy 20,2 gam X phản ứng với tối đa a mol Br2 trong dung dịch
⇒ a = 0,8.0,625 = 0,5 mol
Tính tổng hệ số cân bằng
Cho phương trình phản ứng:
CH3CH=CH2 + KMnO4 + H2O → CH3CHOH-CH2OH + MnO2 + KOH
Tổng hệ số cân bằng (với các hệ số là tối giản) của các chất sau phản ứng là
Phương trình phản ứng
3CH3CH=CH2 + 2KMnO4 + 4H2O → 3CH3CHOH-CH2OH + 2MnO2 + 2KOH.
Tổng hệ số cân bằng của các chất sản phẩm = 3+2+2 = 7
Đồng đẳng của methane
Dãy nào sau đây chỉ gồm các chất là đồng đẳng của methane:
Công thức cấu tạo thu gọn
Cho phản ứng nhiệt phân sau: X ![]() CH4 + C3H6
CH4 + C3H6
Công thức cấu tạo thu gọn của X là
Phương trình phản ứng:
CH3CH2CH2CH3 CH4 + C3H6
Tính tỉ khối của Y so với H2
Cho hỗn hợp X gồm ethylene và H2 có tỉ khối so với H2 bằng 4,25. Dẫn X qua bột nickel nung nóng (hiệu suất phản ứng 80%) thu được hỗn hợp Y. Tỉ khối của Y so với H2 là (các thể tích đo ở cùng điều kiện) là:
Giả sử lấy 1 mol hỗn hợp X. Gọi nC2H4 = x mol; nH2 = y mol
⇒ x + y = 1 (1)
Từ (1) và (2) ⇒ x = 0,25 mol; y = 0,75 mol
Phương trình phản ứng:
C2H4 + H2 C2H6
⇒ Hiệu suất phản ứng tính theo C2H4.
⇒ nC2H4 p/ư = nhh khí giảm = 0,25.0,8 = 0,2 mol
⇒ nY = 1 – 0,2 = 0,8 mol
⇒ dY/H2 = 5,3125
Nitro hoá benzene
Nitro hoá benzene bằng hỗn hợp HNO3 đặc và H2SO4 đặc ở nhiệt độ ≤50oC, tạo thành chất hữu cơ A. Phát biểu nào sau đây về A không đúng?
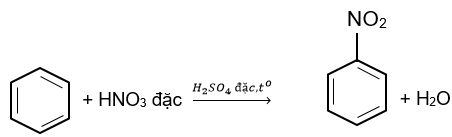
C6H5NO2 có tên là nitrobenzene; là chất lỏng màu vàng, sánh như dầu; không tan trong nước.
Số alkane là chất khí ở điều kiện thường phản ứng với chlorine
Có bao nhiêu alkane là chất khí ở điều kiện thường khi phản ứng với chlorine (có ánh sáng, tỉ lệ mol 1:1) tạo ra 2 dẫn xuất monochloro?
Các alkane là chất khí ở điều kiện thường là: CH4, C2H6, CH3CH2CH3, CH3CH2CH2CH3, (CH3)2CHCH3 (alkane có từ 1C dến 4C)
⇒ Có 3 alkane tạo ra 2 dẫn xuất monochloro là CH3CH2CH3, CH3CH2CH2CH3, (CH3)2CHCH3
Xác định chất thu được sau phản ứng và số mol
Hỗn hợp gồm 1 mol C6H6 và 1,5 mol Cl2. Trong điều kiện có mặt bột FeCl3, to, hiệu suất 100%. Sau phản ứng thu được chất gì? bao nhiêu mol?
Ta có:
phản ứng tạo hỗn hợp hai sản phẩm là C6H5Cl và C6H4Cl2
C6H6 + Cl2 C6H5Cl + HCl
x x
x
x
C6H6 + 2Cl2 C6H4Cl2 + 2HCl
y 2y
y
2y
Theo đề bài ta có:
nC6H6 = x + y = 1 (1)
nCl2 = x + 2y = 1,5 (2)
Giải (1) và (2) thu được x = y = 0,5 mol
Như vậy sau phản ứng thu được: 0,5 mol C6H5Cl; 0,5 mol C6H4Cl2 và 1,5 mol HCl.
Tên gọi CH2=CHCH(CH3)CH3
Ứng với công thức cấu tạo CH2=CHCH(CH3)CH3 có tên gọi là:

Phát biểu không đúng
Phát biểu nào sau đây không đúng?
Khi chiếu sáng hoặc đốt nóng hỗn hợp alkane và chlorine sẽ xảy ra phản ứng thế các nguyên tử hydrogen trong alkane bởi chlorine.
Gọi tên hợp chất CH3-C≡C-CH(CH3)-CH3
Gọi tên hợp chất sau theo danh pháp IUPAC: CH3-C≡C-CH(CH3)-CH3

Vậy tên gọi của chất là: 4-methylpent-2-yne.
Chọn phát biểu không đúng
Phát biểu không đúng về anken:
Ở điều kiện thường, anken từ C2-C4 là chất khí, từ C5 đến C17 là những chất lỏng, từ C18 trở lên là những chất rắn.
Chất nào không làm mất màu dung dịch Br2
Chất nào sau đây không làm mất màu dung dịch Br2?
Hydrocarbon làm mất màu dung dịch Br2 là hydrocarbon không no có chứa liên kết π kém bền (alkene, alkyne, …)
Vậy chất không làm mất màu dung dung dịch Br2 là Methane (CH4)
Công thức cấu tạo của 2,5-dimethylhex-3-yne
Công thức cấu tạo của 2,5-dimethylhex-3-yne là:
Công thức cấu tạo của

Tính khối lượng phân tử trung bình của A
Craking 11 gam propane thu được hỗn hợp A gồm H2, CH4, C2H4, C3H6 và một phần propane chưa bị craking. Biết hiệu suất phản ứng là 85%. Khối lượng phân tử trung bình của A là:
nC3H8 ban đầu = 0,25 mol
nC3H8 pư = 0,25.85% = 0,2125 mol
Vậy sau phản ứng tổng số mol khí trong A là
nA = 0,25 + 0,2125 = 0,4625 mol
Áp dụng định luật bảo toàn khối lượng ta có:
mA = mC3H8 ban đầu = 11 gam
Nhận định nào sau đây về gas là sai
Gas là nhiên liệu đun nấu được sử dụng trong nhiều gia đình, có thành phần chủ yếu là propane và butane. Nhận định nào sau đây về gas là sai?
Với thành phần chủ yếu là các hydrocarbon nên gas không tan trong nước.
Gas là chất khí ở điều kiện thường nhưng được nén với áp suất cao trong bình bằng thép nên gas hóa lỏng, dễ bay hơi, dễ cháy và khi cháy tỏa nhiều nhiệt.
Chất làm mất màu dung dịch KMnO4
Chất nào sau đây làm mất màu dung dịch KMnO4 ở nhiệt độ thường?
Xác định sản phẩm chính của sản phẩm
Khi cho propene tác dụng với dung dịch HBr, theo quy tắc Markovnikov sản phẩm nào sau đây là sản phẩm chính?
Quy tắc Markovnikov: Trong phản ứng cộng HX vào hydrocarbon không no, nguyên tử H ưu tiên cộng vào nguyên tử carbon mang liên kết đôi có nhiều hydrogen hơn (bậc thấp hơn) còn nguyên tử X cộng vào nguyên tử carbon mang liên kết đôi chứa ít hydrogen hơn (bậc cao hơn).
Vậy sản phẩm chính của phản ứng là CH3 – CHBr– CH3
Tính khối lượng kết tủa
Oxi hoá hoàn toàn 0,15 mol hỗn hợp X gồm 2 alkane. Sản phẩm thu được cho đi qua bình 1 đựng H2SO4 đặc, bình 2 đựng dung dịch Ba(OH)2 dư thì khối lượng của bình 1 tăng 9,45 gam và bình 2 có m gam kết tủa xuất hiện. Giá trị của m là:
Khối lượng bình 1 tăng là mH2O
→ nH2O = 9,45 : 18 = 0,525 mol
Ta có: nX = 0,15 và nH2O = 0,525
→ nCO2 = nH2O - nA = 0,525 – 0,15 = 0,375 mol
Cho CO2 + dung dịch Ba(OH)2 dư → kết tủa (BaCO3)
Bảo toàn nguyên tố C ta có: nBaCO3 = nCO2 = 0,375 mol
→ m = 0,375. 197 = 73,875 gam.
Theo Nghị định 147/2024/ND-CP, bạn cần xác thực tài khoản trước khi sử dụng tính năng này. Chúng tôi sẽ gửi mã xác thực qua SMS hoặc Zalo tới số điện thoại mà bạn nhập dưới đây:
