Sulfur và sulfur dioxide
1. Trạng thái tự nhiên
Là nguyên tố phổ biến thứ 17 trên vỏ Trái Đất.
Trong tự nhiên, sulfur tồn tại ở cả dạng đơn chất và hợp chất.
+ Đơn chất tìm thấy chủ yếu ở các vùng có núi lửa.

+ Phần lớn tồn tại dạng hợp chất trong thành phần các khoáng vật
| Tên quặng | Pyrite | Gymsum | Chu sa, thần sa | Chalcopyrite |
| Thành phần | FeS2 | CaSO4.2H2O | HgS | CuFeS2 |
| Hình ảnh |  |
 |
 |
 |
2. Cấu tạo nguyên tử, phân tử
2.1. Cấu tạo nguyên tử

Vị trí trong bảng tuần hoàn
- Ô số 16.
- Chu kì: 3.
- Nhóm: VIA.
Sulfur có tính phi kim.
Số oxi hóa: -2, 0, +4, +6.
Ví dụ: H2S, SO2, SO3, ...
2.2. Cấu tạo phân tử
Phân tử sulfur gồm 8 nguyên tử (S8) có dạng vòng khép kín.
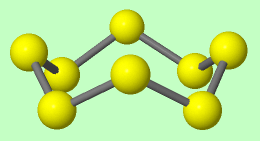
Mỗi nguyên tử sulfur liên kết với hai nguyên tử bên cạnh bằng hai liên kết công hóa trị không phân cực.
3. Tính chất vật lí
Có hai dạng thù hình: dạng tà phương và dạng đơn tà.
Sulfur không tan trong nước, ít tan trong alcohol, tan nhiều trong carbon disulfide.
4. Tính chất hóa học
Sulfur có thể hiện tính oxi hóa hoặc tính khử.
4.1. Sulfur thể hiện tính oxi hóa khi tác dụng với hydrogen và kim loại.
+ Tác dụng với hydrogen tạo thành hydrogen sulfide
S(s) +H2(g) ![]() \(\overset{t^{o} }{\rightarrow}\) H2S(g)
\(\overset{t^{o} }{\rightarrow}\) H2S(g)
+ Tác dụng với kim loại tạo ra muối sulfide
2Al + 3S ![]() \(\overset{t^{o} }{\rightarrow}\) Al2S3
\(\overset{t^{o} }{\rightarrow}\) Al2S3
Hg + S → HgS
(Tác dụng với thủy ngân (mercury) ngay ở nhiệt độ thường)
Lưu ý: Khi nhiệt kế thủy ngân bị vỡ, có thể dùng sulfur để loại bỏ thủy ngân rơi vãi

4.2. Tác dụng với phi kim
S + 3F2 → SF6
S + O2 ![]() \(\overset{t^{o} }{\rightarrow}\) SO2
\(\overset{t^{o} }{\rightarrow}\) SO2
(Sulfur thể hiện tính khử)
5. Ứng dụng

II. Sulfur dioxide
1. Tính chất vật lí
SO2 là chất khí không màu, năng hơn không khí, mùi hắc, tan nhiều trong nước.
SO2 là khí độc.
2. Tính chất hóa học
2.1. Tính oxi hóa
Tác dụng với hydrogen sulfide:
SO2 + 2H2S → 3S + 2H2O
2.2. Tính khử
Tác dụng với nitrogen dioxide (NO2):
SO2 + NO2 ![]() \(\xrightarrow[]{Xúc\: tác}\) SO3 + NO
\(\xrightarrow[]{Xúc\: tác}\) SO3 + NO
Trong không khí sulfur dioxide chuyển hóa thành sulfur trioxide, sau đó kết hợp với hơi nước tạo thành sulfuric acid. Phản ứng giải thích quá trình hình thành mưa acid.
3. Ứng dụng
Là chất trung gian quan trọng trong quá trình sản xuất sulfuric acid.Tẩy trắng và diệt khuẩn.
Là dung môi để thực hiện nhiều phản ứng.
 |
 |
 |
4. Sulfur dioxide và ô nhiễm môi trường
4.1. Nguồn phát sinh
Tự nhiên: khí thải núi lửa …
Nhân tạo: đốt cháy nhiên liệu, quặng sulfide, luyện kim ….
 |
 |
 |
4.2. Tác hại
Gây ô nhiễm khí quyển, gây mưa acid và viêm đường hô hấp ở người.
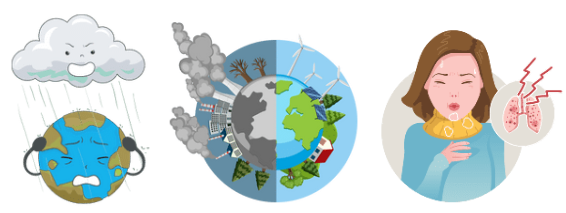
4.3. Biện pháp cắt giảm phát thải sulfur dioxide vào khí quyển
Tăng cường sử dụng các nguồn năng lượng mới, năng lượng sạch, năng lượng tái tạo.
Sử dụng tiết kiệm, hiệu quả nguồn tài nguyên thiên nhiên.
Cải tiến công nghệ sản xuất, có biện pháp xử lí khí thải và tái chế các sản phẩm phụ có chứa sulfur.
 |
 |
 |






