Ammonia. Muối ammonium
1. Cấu tạo phân tử
Phân tử ammonia được tạo bởi một nguyên tử nitrogen liên kết với ba nguyên tử hydrogen và có dạng hình học là chóp tam giác:
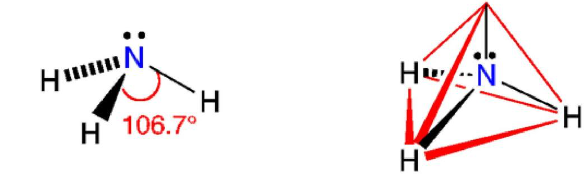
Công thức Lewis và dạng hình học của phân tử ammonia
Đặc điểm cấu tạo của phân tử ammonia:
- Nguyên tử nitrogen còn một cặp electron không liên kết, tạo ra vùng có mật độ điện tích âm trên nguyên tử nitrogen
- Liên kết N-H phân cực, cặp electron dùng chung lệch về nguyên tử nitrogen làm cho nguyên tử hydrogen mang một phần điện tích dương.
- Liên kết N-H tương đối bền với năng lượng liên kết là 386 kJ/mol.
2. Tính chất vật lí
Ammonia tồn tại ở cả trong môi trường đất, nước, không khi. Trong cơ thể người ammonia được tạo ra trong quá trình chuyển hoá thức ăn chứa protein.
Ở điều kiện thường, ammonia tồn tại ở thể khí, không màu, nhẹ hơn không khí, mùi khai và xốc.
Ammonia tan nhiều trong nước. Ở điều kiện thường, 1 lít nước hoà tan được khoảng 700 lit khi ammonia. Ammonia dễ hoá lỏng (hoá lỏng ở -33,3oC) và dễ hoá rắn (hóa rắn ở –77,7oC).
3. Tính chất hoá học
3.1. Tính base
Trong dung dịch, một phần số phân tử ammonia nhận proton của nước, tạo thành ion ammonium (NH4+)
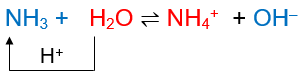
Dung dịch ammonia có môi trường base yếu, làm quỳ tím chuyển màu xanh, phenolphthalein chuyển màu hồng.
Ở thể khí, ammonia cũng có khả năng nhận proton, thể hiện tính chất của một base Bronsted-Lowry.
Ví dụ:
NH3(g) + HCl(g) → NH4Cl(s)
3.2. Tính khử
Trong phân tử ammonia, nguyên tử nitrogen có số oxi hoá −3 (số oxi hóa thấp nhất của nitrogen) nên ammonia thể hiện tính khử.
Đốt cháy trong oxygen, ammonia cháy với ngọn lửa màu vàng.
4NH3 + 3O2 ![]() \(\overset{t^{o} }{\rightarrow}\) 2N2 + 6H2O
\(\overset{t^{o} }{\rightarrow}\) 2N2 + 6H2O
Trong công nghiệp, phản ứng giữa ammonia và oxygen được thực hiện ở nhiệt độ 800oC - 900oC với xúc tác Pt.
4NH3 + 5O2 ![]() \(\xrightarrow[Pt]{t^{o} }\) 4NO + 6H2O
\(\xrightarrow[Pt]{t^{o} }\) 4NO + 6H2O
4. Ứng dụng
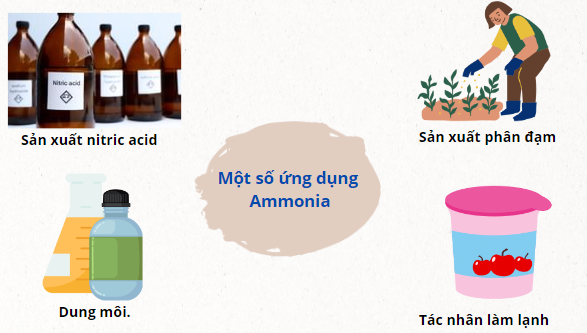
Một số ứng dụng Ammonia
5. Sản xuất
Trong công nghiệp, quá trình sản xuất ammonia thường được thực hiện ở nhiệt độ 400oC – 450oC, áp suất 150 – 200 bar, xúc tác Fe.
N2 (g) + 3H2 (g) ![]() \(\overset{t^{o},p,xt }{\rightleftharpoons}\) 2NH3 (g)
\(\overset{t^{o},p,xt }{\rightleftharpoons}\) 2NH3 (g)
II. Muối Ammonium
1. Tính tan, sự điện li
Một số muối ammonium phổ biến:
NH4Cl, NH4ClO4, NH4NO3, (NH4)2SO4, NH4H2PO4, (NH4)2HPO4, NH4HCO3
Hầu hết các muối ammonium đều dễ tan trong nước và phân li hoàn toàn ra ion.
Ví dụ: NH4Cl → NH4+ + Cl-
2. Tác dụng với kiềm - Nhận biết ammonium
Khi đun nóng hỗn hợp muối ammonium với dung dịch kiềm, sinh ra khí ammonia với mùi khai.
Ví dụ:
(NH4)2SO4 + 2NaOH ![]() \(\xrightarrow{t^o}\) Na2SO4 +2NH3 + 2H2O
\(\xrightarrow{t^o}\) Na2SO4 +2NH3 + 2H2O
Phương trình ion rút gọn:
NH4+ + OH- ![]() \(\xrightarrow{t^o}\) NH3 + H2O.
\(\xrightarrow{t^o}\) NH3 + H2O.
3. Tinh chất kém bền nhiệt
Các muối ammonium đều kém bền nhiệt và dễ bị phân huỷ khi nung nóng.
Ví dụ:
NH4Cl ![]() \(\xrightarrow{t^o}\) NH3 + HCl
\(\xrightarrow{t^o}\) NH3 + HCl
NH4HCO3 ![]() \(\xrightarrow{t^o}\) NH3 + CO2 + H2O
\(\xrightarrow{t^o}\) NH3 + CO2 + H2O
NH4NO3 ![]() \(\xrightarrow{t^o}\) N2O + 2H2O
\(\xrightarrow{t^o}\) N2O + 2H2O
4. Ứng dụng
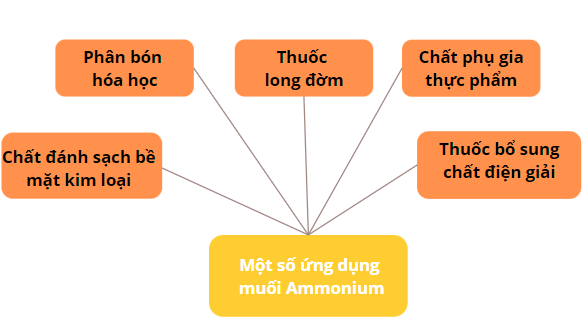 Một số ứng dụng muối Ammonium
Một số ứng dụng muối Ammonium






