Độ tan là gì? Công thức tính độ tan
Công thức tính độ tan
Độ tan là gì? Công thức tính độ tan được VnDoc biên soạn tổng hợp lại nội dung khái niệm độ tan là gì, công thức tính độ tan cũng như các công thức biến đổi liên quan đến độ tan.
Từ đó giúp các bạn biết cách vận dụng vào làm các dạng bài tập về độ tan trong chương trình khoa học tự nhiên trung học cơ sở.
>> Mời các bạn tham khảo thêm một số câu hỏi liên quan:
- Khi giảm nhiệt độ và tăng áp suất thì độ tan của chất khí trong nước
- Muối nào sau đây không tan trong nước
- Khi tăng nhiệt độ và giảm áp suất thì độ tan của chất khí trong nước thay đổi như thế nào
I. Độ tan là gì?
Độ tan của một chất trong nước là số gam tối đa chất đó hoà tan trong 100 gam nước để tạo thành dung dịch bão hoà ở một nhiệt độ, áp suất xác định.
Ví dụ. Nếu một chất có độ tan là 20% trong nước, điều đó có nghĩa là trong 100 g dung dịch, có 20 g là chất tan và 80 g là nước.
II. Công thức tính độ tan
Độ tan được tính theo công thức:
![]()
Trong đó
S là độ tan (đơn vị gam/100 gam nước);
mct là khối lượng chất tan (đơn vị gam);
mdm là khối lượng dung môi (đơn vị gam);
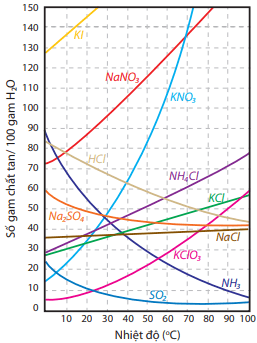
Nói chung, độ tan của chất rắn sẽ tăng khi tăng nhiệt độ (trừ một số ít trường hợp); độ tan của chất khí sẽ tăng khi giảm nhiệt độ và tăng áp suất.
Ví dụ: Ở 25oC, 250 gam nước có thể hòa tan tối đa 80 gam KNO3. Độ tan của KNO3 ở 25oC là
Hướng dẫn trả lời
Ở 25oC, 250 gam nước có thể hòa tan tối đa 80 gam KNO3.
Ở 25oC, 100 gam nước có thể hòa tan tối đa x gam KNO3.
Vậy ![]()
III. Những yếu tố ảnh hưởng đến độ tan
Độ tan của chất rắn phụ thuộc vào nhiệt độ. Phần lớn tăng nhiệt độ thì độ tan của chất rắn tăng.
Độ tan của chất khí phụ thuộc vào nhiệt độ và áp suất. Độ tan của chất khí tăng khi giảm nhiệt độ và tăng áp suất.
IV. Bảng tính tan trong nước của các Acid - Base -Muối
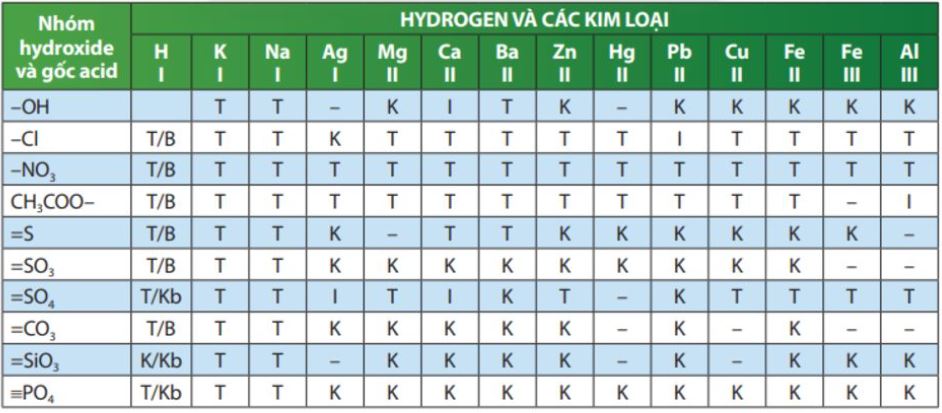
Chú thích các kí hiệu:
T: hợp chất tan trong nước;
K: hợp chất không tan trong nước;
I: hợp chất tan trong nước;
B: Hợp chất dễ bay hơi hoặc dễ bị phân huỷ thành khí bay lên;
Kb: hợp chất không bay hơi "-": hợp chất không tồn tại hoặc bị phân huỷ trong nước.
V. Bài tập vận dụng liên quan
Ví dụ 1: Tính độ tan của MgSO4 ở 20oC biết rằng ở nhiệt độ này 360 ml nước có thể hòa tan tối đa 129,6 gam MgSO4 tạo thành dung dịch bão hòa
Đáp án hướng dẫn giải chi tiết
Ta có: ![]() = 129,6/360 .100 = 36 (g/100g nước)
= 129,6/360 .100 = 36 (g/100g nước)
Ví dụ 2. Ở 25oC, độ tan của NaCl là 36 gam. Thể tích nước cần dùng để hòa tan 1 mol NaCl ở cùng nhiệt độ trên là bao nhiêu?
Đáp án hướng dẫn giải chi tiết
Theo đề bài ta có mNaCl = n.M = 58,5 gam
Ta có: ![]() = 58,5/36.100 = 162,5 gam
= 58,5/36.100 = 162,5 gam
=> VH2O = 162,5 ml
Ví dụ 3. Xác định độ tan của Na2CO3 trong nước ở 18oC, biết ở nhiệt độ này, hoà tan hết 143 g Na2CO3.10H2O trong 250g nước thì được dung dịch bão hoà
Đáp án hướng dẫn giải chi tiết
nNa2CO3.10H2O = 143/286 = 0,5mol
=> mNa2CO3 = 0,5.106 =53 gam
=> mH2O = 0,5.180=90 gam
Tổng khối lượng nước : 90 + 250 = 340 gam
S = 53/340.100 = 15,59
Vậy độ tan của Na2CO3 ở 18oC là 15,59 gam
Ví dụ 4. Một dung dịch có chứa 26,5g NaCl trong 75g H2O ở 250C. hãy xác định dung dịch NaCl nói trên là bão hòa hay chưa bão hòa? Biết độ tan của NaCl trong nước ở 250C là 36g.
Đáp án hướng dẫn giải chi tiết
100g H2O ở 250C hòa tan 36g NaCl
75g H2O ở 250C hòa tan x?g NaCl
x = (75.36)/100 = 27 gam
Dung dịch NaCl đã pha chế là chưa bão hòa.
Vì dung dịch này có thể hòa tan thêm: 27 - 26,5 = 0,5(g) NaCl ở 250C
Ví dụ 5. Độ tan của NaCl trong nước là 25oC là 44 gam. Khi mới hòa tan 20 gam NaCl vào 50 gam nước thì phải hòa tan thêm bao nhiêu gam NaCl để được dung dịch bão hòa?
Đáp án hướng dẫn giải chi tiết
Gọi khối lượng NaCl cần hòa tan thêm là m
=> Khối lượng NaCl hòa tan vào 50 gam nước để tạo dd bão hòa là: mct = m + 20
Ta có: mdm = 50 gam
Áp dụng công thức tính độ tan:
![]() => (m + 20)/50.100 = 44
=> (m + 20)/50.100 = 44
=> m = 2 gam
VI. Bài tập vận dụng tự luyện
Bài tập số 1: Ở 20oC, 60 gam KNO3 tan trong 190 nước thì thu được dung dịch bão hoà. Tính độ tan của KNO3 ở nhiệt độ đó ?
Bài tập số 2: ở 20oC, độ tan của K2SO4 là 11,1 gam. Phải hoà tan bao nhiêu gam muối này vào 80 gam nước thì thu được dung dịch bão hoà ở nhiệt độ đã cho ?
Bài tập số 3: Tính khối lượng KCl kết tinh đợc sau khi làm nguội 600 gam dung dịch bão hoà ở 80oC xuống 20oC. Biết độ tan S ở 80oC là 51 gam, ở 20oC là 34 gam.
Bài tập số 4: Biết độ tan S của AgNO3 ở 60oC là 525 gam, ở 10oC là 170 gam. Tính lượng AgNO3 tách ra khi làm lạnh 2500 gam dung dịch AgNO3 bão hoà ở 60oC xuống 10oC.
Bài tập số 5: Hoà tan 120 gam KCl và 250 gam nớc ở 50oC (có độ tan là 42,6 gam). Tính lượng muối còn thừa sau khi tạo thành dung dịch bão hoà?
VII. Bài tập trắc nghiệm về độ tan
Câu 1. Khi tăng nhiệt độ thì độ tan của các chất rắn trong nước:
A. Đa số là tăng
B. Đa số là giảm
C. Biến đổi ít
D. Không biến đổi
Câu 2. Base không tan?
A. Zn(OH)2
B. Ba(OH)2
C. Ca(OH)2
D. KOH
Base không tan là Zn(OH)2
Còn lại Ba(OH)2, Ca(OH)2, KOH là các base tan
Câu 3. Độ tan của chất rắn phụ thuộc vào
A. Nhiệt độ
B. Áp suất
C. Loại chất
D. Môi trường
Độ tan của chất rắn phụ thuộc vào Nhiệt độ
Câu 4. Độ tan là gì
A. Số kilogam chất đó tan được trong một lít nước để tạo ra dung dich bão hòa để nhiệt độ xác định
B. Là số gam chất đó tan ít nhất trong 100 g nước để tạo thành dung dich bão hòa ở nhiệt độ xác định
C. Là số gam chất đó tan nhiều nhất trong 100 g nước để tạo thành dung dich bão hòa nhiệt độ xác định
D. Là số gam chất đó không tan trong 100 g nước để tạo thành dung dich bão hòa ở nhiệt độ xác định
Độ tan là gì Số kilogam chất đó tan được trong một lít nước để tạo ra dung dich bão hòa để nhiệt độ xác định
Câu 5. Chọn kết luận đúng
A. Muối chloride đều là muối tan
B. Muối sắt là muối tan
C. Muối của kim loại kiềm đều là muối tan
D. AgCl là muối tan
Câu 6. Khi tăng nhiệt độ và giảm áp suất thì độ tan của chất khí trong nước thay đổi như thế nào
A. đều tăng.
B. đều giảm.
C. có thể tăng và có thể giảm.
D. không tăng và cũng không giảm.
Khi giảm nhiệt độ và tăng áp suất thì độ tan của chất khí trong nước: đều tăng
Câu 7. Có một cốc đựng dung dịch NaCl bão hòa ở nhiệt độ phòng. Làm thế nào để dung dịch đó trở thành chưa bão hòa?
A. Cho thêm tinh thể NaCl vào dung dịch.
B. Cho thêm nước cất vào dung dịch.
C. Đun nóng dung dịch.
D. cả B và C đều đúng.
Để dung dịch đó trở thành chưa bão hòa ta có thể :
Cho thêm nước cất vào dung dịch => tạo thành dung dịch loãng hơn, có thể tan thêm NaCl.
Đun nóng dung dịch => độ tan tăng, muối có khả năng tan nhiều hơn => tạo thành dd chưa bão hòa
Câu 8. Hòa tan 14,36 gam NaCl vào 40 gam nước ở nhiệt độ 20oC thì thu được dung dịch bão hòa. Độ tan của NaCl ở nhiệt độ đó là
A. 35,5 gam.
B. 35,9 gam.
C. 36,5 gam.
D. 37,2 gam.
Hòa tan 14,36 gam NaCl vào 40 gam nước thu được dung dịch bão hòa
=> mct = 14,36 gam và mdm = 40 gam
Áp dụng công thức tính độ tan: S = mct/mdm.100 =14,36/40.100 = 35,9 gam
Câu 9. Chọn câu đúng khi nói về độ tan.
Độ tan của một chất trong nước ở nhiệt độ xác định là:
A. Số gam chất đó tan trong 100g dung dịch.
B. Số gam chất đó tan trong 100g dung môi
C. Số gam chất đó tan trong nước tạo ra 100g dung dịch
D. Số gam chất đó tan trong 100g nước để tạo dung dịch bão hoà
Độ tan của một chất trong nước ở nhiệt độ xác định là: Số gam chất đó tan trong 100g nước để tạo dung dịch bão hoà
Câu 10. Nhận định nào sau đây đúng về độ tan một chất trong nước?
A. Chất rắn tan trong nước phụ thuộc áp suất.
B. Chất khí tan trong nước phụ thuộc thể tích nước.
C. Chất lỏng không tan trong nước.
D. Chất rắn tan trong nước phụ thuộc nhiệt độ.
A sai vì chất rắn tan trong nước phụ thuộc nhiệt độ, không phụ thuộc áp suất.
B sai vì chất khí tan trong nước phụ thuộc áp suất.
C sai vì chất lỏng có thể tan trong nước.
Câu 11. Chọn câu đúng khi nói về độ tan.Độ tan của một chất trong nước ở nhiệt độ xác định là:
A. Số gam chất đó tan trong 100g dung dịch.
B. Số gam chất đó tan trong 100g dung môi
C. Số gam chất đó tan trong nước tạo ra 100g dung dịch
D. Số gam chất đó tan trong 100g nước để tạo dung dịch bão hoà
Câu 12. Các câu sau, câu nào đúng khi định nghĩa dung dịch?
A. Dung dịch là hỗn hợp đồng nhất của chất rắn và chất lỏng.
B. Dung dịch là hỗn hợp đồng nhất của chất khí và chất lỏng
C. Dung dịch là hỗn hợp đồng nhất của hai chất lỏng.
D. Dung dịch là hỗn hợp đồng nhất của chất tan và dung môi
Câu 13. Độ tan của một chất trong nước ở nhiệt độ xác định là
A. Số gam chất đó có thể tan trong 100 ml dung dịch
B. Số gam chất đó có thể tan trong 100 ml nước.
C. Số gam chất đó có thể tan trong 100 gam nước để tạo thành dung dịch bão hòa.
D. Số gam chất đó có thể tan trong 100 gam dung môi để tạo thành dung dịch bão hòa
Độ tan của một chất trong nước ở nhiệt độ xác định là số gam chất đó có thể tan trong 100 gam nước để tạo thành dung dịch bão hòa
Câu 14. Tiến hành thí nghiệm nhỏ vài giọt dung dịch NaOH vào ống nghiệm đựng sẵn dung dịch FeCl3, hiện tượng quan sát được là:
A. Xuất hiện kết tủa trắng xanh.
B. Có khí thoát ra.
C. Xuất hiện kết tủa đỏ nâu.
D. Xuất hiện Kết tủa màu trắng.
Cho dung dịch NaOH vào ống nghiệm đựng dung dịch FeCl3, xảy ra phản ứng:
3NaOH + FeCl3 → Fe(OH)3 ↓ + 3NaCl
Fe(OH)3 kết tủa màu đỏ nâ
Câu 15. Cho m gam Na2CO3 vào dung dịch HCl, sau phản ứng thu được 7,437 lít khí ở đkc. Giá trị của m là
A. 15,9 gam
B. 31,8 gam
C. 34,8 gam
D. 18,2 gam
Phương trình phản ứng hóa học:
Na2CO3 + 2HCl → 2NaCl + CO2 ↑ + H2O
nCO2 = 7,437:24,79 = 0,3 mol
Theo phương trình hóa học:
nNa2CO3 = nCO2 = 0,3 mol
=> m = mNa2CO3 = 0,3.106 = 31,8 gam
Câu 16. Dãy chỉ gồm các chất tan tốt trong nước?
A. Ba(OH)2, Mg(OH)2, Ca(OH)2, Sr(OH)2
BaSO4, MgSO4, CaSO4, SrSO4
Câu 17. Dãy gồm các muối đều tan trong nước là
A. CaCO3, BaCO3, Mg(HCO3)2, K2CO3.
B. CaCO3, BaCO3, NaHCO3, MgCO3.
C. Na2CO3, Ca(HCO3)2, Ba(HCO3)2, K2CO3.
D. BaCO3, NaHCO3, Mg(HCO3)2, Na2CO3.
Một số muối carbonate của kim loại kiềm tan (Na2CO3, K2CO3,…) và hầu hết muối hydrocarbonate tan trong nước (Ba(HCO3)2, Ca(HCO3)2, Mg(HCO3)2,NaHCO3,…)
................................









