Giải bài tập Hóa học 12 SBT bài 23
Hóa học 12 - Luyện tập: Điều chế kim loại và sự ăn mòn kim loại
VnDoc xin giới thiệu tới bạn đọc tài liệu Giải bài tập Hóa học 12 SBT bài 23. Nội dung tài liệu kèm theo lời giải chi tiết sẽ giúp các bạn học sinh rèn luyện giải Hóa học 12 một cách hiệu quả hơn. Mời các bạn học sinh và thầy cô cùng tham khảo.
Giải bài tập Hóa học 12 SBT bài 22
Giải bài tập Hóa học 12 bài 23: Luyện tập Điều chế kim loại và sự ăn mòn kim loại
Giáo án Hóa học lớp 12 bài 23: Luyện tập điều chế kim loại và sự ăn mòn kim loạị
Giải bài tập Hóa học 12 SBT
Bài 5.116, 5.117, 5.118 trang 52 sách bài tập (SBT) Hóa học 12
5.116. Cho khí CO dư đi qua hỗn hợp gồm CuO, Al2O3 và MgO (nung nóng). Khi phản ứng xảy ra hoàn toàn thu được chất rắn gồm
A. Cu, Al, Mg.
B. Cu, Al, MgO.
C. Cu, Al2O3, Mg.
D. Cu, Al2O3, MgO.
5.117. Hòa tan 28 g Fe vào dung dịch AgNO3 dư đến khi phản ứng hoàn toàn thì khối lượng chất rắn thu được là
A. 108g.
B. 162 g.
C. 216 g.
D. 154 g.
5.118. Điện phân 400 ml dung dịch CuSO4 0,2M với cường độ dòng điện 10A trong một thời gian thu được 0,224 lít khí (đktc) ở anot. Biết điện cực đã dùng là điện cực trơ và hiệu suất điện phân là 100%. Khối lượng catot tăng là
A. 1,28 g.
B. 0,32 g.
C. 0,64 g.
D. 3,2 g.
5.116. D
5.117. B
5.118. A
Bài 5.119, 5.120, 5.121 trang 53 sách bài tập (SBT) Hóa học 12
5.119. Cuốn một sợi dây thép vào một thanh kim loại rồi nhúng vào dung dịch H2SO4 loãng. Quan sát thấy bọt khí thoát ra rất nhanh từ sợi dây thép. Thanh kim loại đã dùng có thể là
A. Cu.
B. Ni.
C. Zn.
D. Pt.
5.120. Ngâm một lá Zn vào dung dịch HCl thấy bọt khí thoát ra ít và chậm. Nếu nhỏ thêm vào vài giọt dung dịch X thì thấy bọt khí thoát ra rất nhiều và nhanh. Chất tan trong dung dịch X là
A. H2S04.
B. FeS04.
C. NaOH.
D. MgS04.
5.121. Cắm 2 lá kim loại Zn và Cu nối với nhau bằng một sợi dây dẫn vào cốc thuỷ tinh. Rót dung dịch H2S04 loãng vào cốc thuỷ tinh đó thấy khí H2 thoát ra từ lá Cu. Giải thích nào sau đây không đúng với thí nghiệm trên?
A. Cu đã tác dụng với H2S04 sinh ra H2.
B. Ở cực dương xảy ra sự khử H+: 2H++ 2e —> H2.
C. Ở cực âm xảy ra sự oxi hoá Zn: Zn —> Zn2+ + 2e.
D. Zn bị ăn mòn điện hoá và sinh ra dòng điện.
Hướng dẫn trả lời:
5.119. C
5.120. B
5.121. A
Bài 5.122 trang 53 sách bài tập (SBT) Hóa học 12
Giải thích vì sao để bảo vệ vỏ tàu biển bằng thép, người ta lại gắn những tấm kẽm vào vỏ tàu (phần vỏ ngâm dưới nước biển).
Hướng dẫn trả lời:
Để chống lại sự ăn mòn vỏ tàu bằng thép ngâm trong nước biển, người ta gắn những tấm kẽm ở nhiều chỗ trên thân tàu. Các pin Zn - Fe được tạo thành, Fe (vỏ tàu) đóng vai trò là catot, không bị ăn mòn, còn Zn là anot bị ăn mòn thay cho Fe.
Bài 5.123 trang 53 sách bài tập (SBT) Hóa học 12
Trình bày phương pháp hoá học để có thể tách riêng từng kim loại ra khỏi một dung dịch có chứa các muối:
a) FeSO4 và CuSO4.
b) NaCl và CuCl2.
Hướng dẫn trả lời:
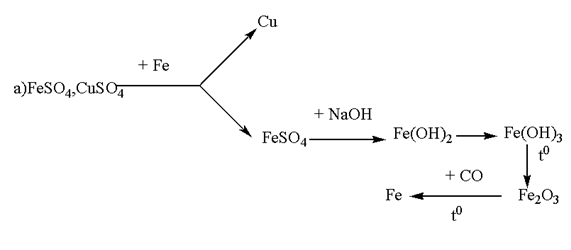
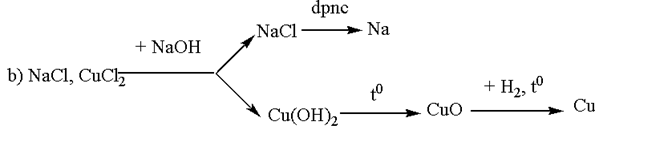
Bài 5.124 trang 53 sách bài tập (SBT) Hóa học 12
Trình bày sơ đồ tách riêng từng kim loại từ hỗn hợp các kim loại: Cu, Fe, Al, Ag.
Hướng dẫn trả lời:
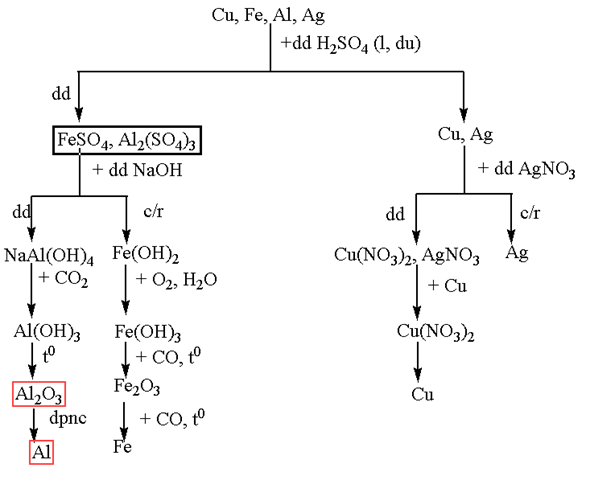
Bài 5.125 trang 53 sách bài tập (SBT) Hóa học 12
Hoà tan hiđroxit kim loại M(OH)2 bằng một lượng vừa đủ dung dịch H2SO4 20% thu được dung dịch muối có nồng độ 27,21%. Xác định kim loại M.
Hướng dẫn trả lời:
Ta có PTHH: M(OH)2 + H2SO4 → MSO4 + 2H2O
x → x → x
![]() \(m ddH2SO4 = 98x.{{100} \over {20}} = 490x(g)\)
\(m ddH2SO4 = 98x.{{100} \over {20}} = 490x(g)\)
⟹ mdd sau phản ứng = (M+34)x + 490x = (M + 524)x (gam)
Ta lại có: mMSO4 =(M + 96)x
⟹ C%MSO4=![]() \({{(M + 96)x} \over {(M + 524)x}} = 0,2721\)
\({{(M + 96)x} \over {(M + 524)x}} = 0,2721\)
⟺ M = 64 Vậy kim loại cần tìm là Cu.
Bài 5.126 trang 53 sách bài tập (SBT) Hóa học 12
Nhiệt phân hoàn toàn 9,4 gam một muối nitrat kim loại M hoá trị không đổi được 4 gam oxit và hỗn hợp khí NO2 và O2. Xác định công thức muối của kim loại M.
Hướng dẫn trả lời:
Vì sau khi nhiệt phân thu được oxit kim loại nên loại AgNO3.
Để đơn giản ta giả sử M có hoá trị II:
2M(NO3)2 ⟶ 2MO + 4NO2+ ![]() \({1 \over 2}\) O2
\({1 \over 2}\) O2
x ⟶ 2x ⟶ ![]() \({1 \over 2}x\)(mol)
\({1 \over 2}x\)(mol)
Nhận thấy khối lượng chất rắn giảm bằng khối lượng khí thoát ra
⟹ mNO2 + mO2 = 9,4 - 4 = 5,4 g
⟶ 46.2x + 16x = 5,4 ⟶ x = 0,05
![]() \(\to {M_{M{{(N{O_3})}_2}}} = {{9,4} \over {0,05}} = 188 \to {M_M} = 64\)
\(\to {M_{M{{(N{O_3})}_2}}} = {{9,4} \over {0,05}} = 188 \to {M_M} = 64\)
Vậy muối đó là Cu(NO3)2.
----------------------------------
Để có kết quả cao hơn trong học tập, VnDoc xin giới thiệu tới các bạn học sinh tài liệu Giải bài tập Toán lớp 12, Giải bài tập Hóa học lớp 12, Giải bài tập Vật Lí 12 mà VnDoc tổng hợp và đăng tải.


