Giải Khoa học tự nhiên 7 Bài 6: Giới thiệu về liên kết hóa học KNTT
Giải KHTN 7 Kết nối tri thức Bài 6: Giới thiệu về liên kết hóa học
Khoa học tự nhiên 7 Bài 6: Giới thiệu về liên kết hóa học KNTT được VnDoc biên soạn hướng dẫn bạn đọc trả lời các nội dung câu hỏi, bài tập sách giáo khoa Khoa học tự nhiên lớp 7 Kết nối tri thức bài 6. Hy vọng tài liệu mang đến cho bạn đọc các nội dung kiến thức bổ ích trong quá trình học tập, soạn bài và làm bài.
>> Bài trước đó: Khoa học tự nhiên 7 Bài 5: Phân tử - Đơn chất - Hợp chất
I. Cấu trúc electron bền vững của khí hiếm
Câu hỏi Trang 36 SGK Khoa học tự nhiên 7 KNTT
Quan sát hình 6.1, so sánh số electron lớp ngoài cùng của He, Ne và Ar.
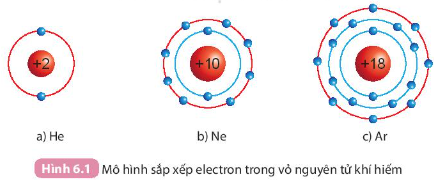
Hướng dẫn trả lời câu hỏi
He có 2 electron ở lớp vỏ ngoài cùng
Ne có 8 electron ở lớp vỏ ngoài cùng
Ar có 8 electron ở lớp vỏ ngoài cùng
Nguyên tố He có số electron ở lớp vỏ ngoài cùng ít hơn. Nguyên tố Ne và Ar có số electron ở lớp vỏ ngoài cùng bằng nhau (đều bằng 8)
II. Liên kết ion
Câu hỏi Trang 37 SGK Khoa học tự nhiên 7 KNTT
Câu 1. Quan sát Hình 6.2 và so sánh số electron ở lớp ngoài cùng của nguyên tử Na, Cl với ion Na+, Cl-

Hướng dẫn trả lời câu hỏi
Số electron lớp ngoài cùng của nguyên tử Na nhiều hơn số electron lớp ngoài cùng của ion Na+
Số electron lớp ngoài cùng của nguyên tử Cl ít hơn số electron lớp ngoài cùng của ion Cl-
Câu 2. Cho sơ đồ mô tả sự hình thành liên kết ion trong phân tử magnesium oxide như sau:
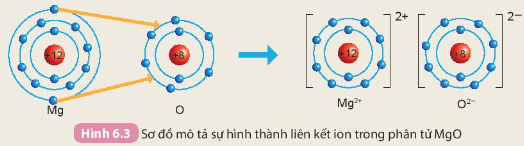
Hãy cho biết nguyên tử Mg đã nhường hay nhận bao nhiêu electron
Hướng dẫn trả lời câu hỏi
Nguyên tử Mg có 12 electron. Ion Mg2+ có tất cả 10 electron
=> Mất đi 2 electron ở lớp vỏ ngoài cùng
=> Nguyên tử Mg đã nhường đi 2 electron ở lớp vỏ ngoài cùng
III. Liên kết cộng hóa trị
1. Liên kết cộng hóa trị trong phân tử đơn chất
Câu hỏi Trang 38 SGK Khoa học tự nhiên 7 KNTT
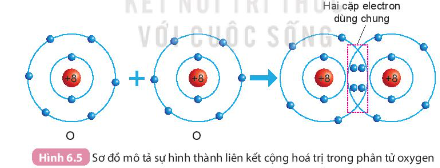
Câu 1. Quan sát Hình 6.4 và Hình 6.5, cho biết số electron lớp ngoài cùng của H và O trước và sau khi tạo thành liên kết cộng hóa trị.
 |
 |
Hướng dẫn trả lời câu hỏi
- Xét Hình 6.4:
+ Trước khi tạo thành liên kết cộng hóa trị, H có 1 electron ở lớp vỏ ngoài cùng
+ Sau khi tạo thành liên kết cộng hóa trị, H có 2 electron ở lớp vỏ ngoài cùng
- Xét Hình 6.5:
+ Trước khi tạo thành liên kết cộng hóa trị, O có 6 electron ở lớp vỏ ngoài cùng (lớp 2)
+ Sau khi tạo thành liên kết cộng hóa trị, O có 8 electron ở lớp vỏ ngoài cùng (lớp 2)
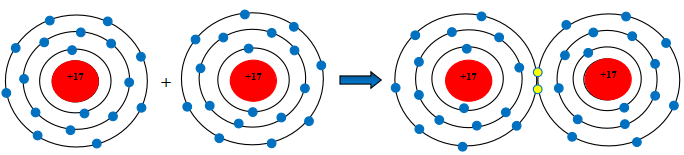
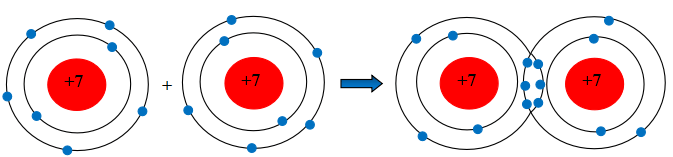
Câu 2. Hãy mô tả sự hình thành liên kết cộng hóa trị trong phân tử khí chlorine, khí nitrogen.
Hướng dẫn trả lời câu hỏi
Sự hình thành liên kết cộng hóa trị trong phân tử khí chlorine
Mỗi nguyên tử Cl có 7 electron ở lớp ngoài cùng. Để có cấu trúc electron bền vững của khí hiếm Ne, khi hình thành phân tử nitrogen, hai phân tử Cl đã liên kết với nhau bằng cách mỗi nguyên tử N góp chung 1 electron tạo thành 1 cặp electron dùng chung.
Sự hình thành liên kết cộng hóa trị trong phân tử khí khí nitrogen
Mỗi nguyên tử N có 5 electron ở lớp ngoài cùng. Để có cấu trúc electron bền vững của khí hiếm Ne, khi hình thành phân tử nitrogen, hai phân tử N đã liên kết với nhau bằng cách mỗi nguyên tử N góp chung 3 electron tạo thành 3 cặp electron dùng chung.
2. Liên kết cộng hóa trị trong phân tử hợp chất
Câu hỏi trang 39 SGK Khoa học tự nhiên 7 KNTT
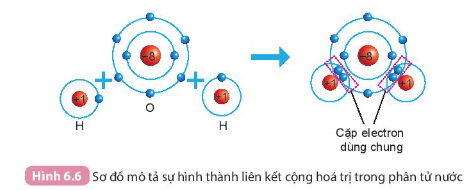
Câu 1. Quan sát Hình 6.6 và cho biết khi nguyên tử O liên kết với hai nguyên tử H theo cách dùng chung electron thì lớp vỏ của nguyên tử oxygen giống với lớp vỏ của nguyên tử khí hiếm nào?
Hướng dẫn trả lời câu hỏi
Khi nguyên tử O liên kết với 2 nguyên tử H bằng cách góp chung electron thì nguyên tử O có 10 electron (2 electron lớp thứ nhất, 8 electron ở lớp thứ 2)
Giống cấu hình electron của khí hiếm Neon (Ne)
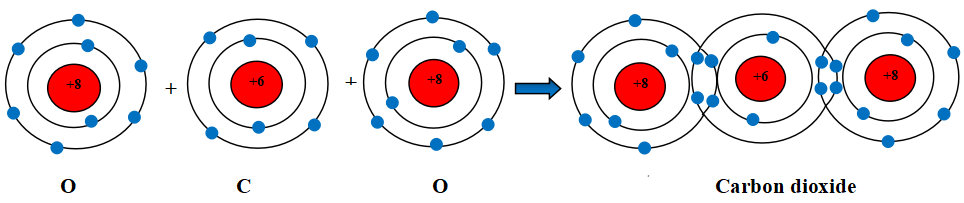
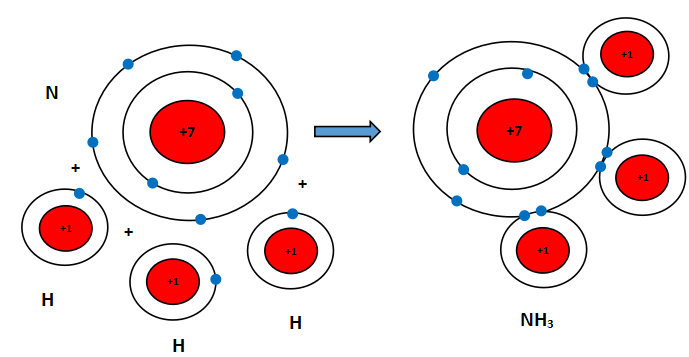
Câu 2. Hãy mô tả sự hình thành liên kết cộng hóa trị trong phân tử carbon dioxide, ammonia (gồm một nguyên tử N liên kết với ba nguyên tử H)
Hướng dẫn trả lời câu hỏi
Sự hình thành liên kết cộng hóa trị trong phân tử carbon dioxide
Khi hình thành phân tử carbon dioxide, hai nguyên tử O đã liên kết với một nguyên tử C bằng cách nguyên tử C góp chung với mỗi nguyên tử O hai electron tạo thành hai cặp electron dùng chung với mỗi nguyên tử O.
Sự hình thành liên kết cộng hóa trị trong phân tử ammonia
Khi hình thành phân tử ammonia, ba nguyên tử H đã liên kết với một nguyên tử N bằng cách nguyên tử N góp chung với mỗi nguyên tử H một electron tạo thành cặp electron dùng chung.
>> Bài tiếp theo: Khoa học tự nhiên 7 Bài 7: Hóa trị và công thức hóa học
IV. Trắc nghiệm Khoa học tự nhiên 7 Bài 6
Để giúp bạn đọc củng cố lý thuyết, cũng như ôn tập lại các nội dung bài tập sách giáo khoa Khoa học tự nhiên 7 sau mỗi bài học. VnDoc đã biên soạn bộ câu hỏi luyện tập theo bài dưới hình thức trắc nghiệm mời các bạn luyện tập trực tiếp tại:








