Giải bài tập Hóa học 12 SBT bài 25
Hóa học 12 - Kim loại kiềm và hợp chất quan trọng của kim loại kiềm
VnDoc xin giới thiệu tới bạn đọc tài liệu Giải bài tập Hóa học 12 SBT bài 25. Nội dung tài liệu kèm theo lời giải chi tiết sẽ giúp các bạn học sinh rèn luyện giải Hóa học 12 một cách chính xác nhất. Mời các bạn học sinh tham khảo.
Giải bài tập Hóa học 12 SBT bài 23
Giải bài tập Hóa học 12 bài 25: Kim loại kiềm và hợp chất quan trọng của kim loại kiềm
Giáo án Hóa học lớp 12 bài 25: Kim loại kiềm và hợp chất quan trọng của kim loại kiềm
Giải bài tập Hóa học 12 SBT
Bài 6.1, 6.2, 6.3, 6.4 trang 54 sách bài tập (SBT) Hóa học 12
6.1. Những nguyên tố trong nhóm IA của bảng tuần hoàn được sắp xếp từ trên xuống dưới theo thứ tự tăng dần của
A. điện tích hạt nhân nguyên tử.
B. khối lượng riêng.
C. nhiệt độ sôi.
D. số oxi hoá.
6.2. Cho 3 g hỗn hợp gồm Na và kim loại kiềm M tác dụng với nước. Để trung hoà dung dịch thu được cần 800 ml dung dịch HCl 0,25M. Kim loại M là
A. Li.
B. Cs.
C. K.
D. Rb.
6.3. Cho 4,7 g K2O vào 195,3 g nước. Nồng độ phần trăm của dưng dịch thu được là
A.2,6%.
B. 6,2%.
C. 2,8%.
D. 8,2%.
6.4. Cho 17 g hỗn hợp X gồm hai kim loại kiềm đứng kế tiếp nhau trong nhóm IA tác dụng với nước thu được 6,72 lít H2 (đktc) và dung dịch Y.
a) Hỗn hợp X gồm
A. Li và Na.
B. Na và K.
C. K và Rb.
D. Rb và Cs.
b) Thể tích dung dịch HCl 2M cần để trung hoà dung dịch Y là
A. 200 ml.
B. 250 ml.
C. 300 ml.
D. 350 ml.
Hướng dẫn trả lời:
6.1. A
6.2. A
6.3. C
6.4a. B
6.4b. C
6.2. Chọn A
![]() \({n_{HCl}} = 0,8.0,25 = 0,2\left( {mol} \right)\)
\({n_{HCl}} = 0,8.0,25 = 0,2\left( {mol} \right)\)
![]() \(\overline M + {H_2}O \to \overline M OH + {1 \over 2}{H_2}\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\left( 1 \right)\)
\(\overline M + {H_2}O \to \overline M OH + {1 \over 2}{H_2}\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\left( 1 \right)\)
![]() \(\overline M OH + HCl \to \overline M Cl + {H_2}O\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\left( 2 \right)\)
\(\overline M OH + HCl \to \overline M Cl + {H_2}O\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\left( 2 \right)\)
Từ (1), (2):
![]() \({n_{hh}} = {n_{HCl}} = 0,2\left( {mol} \right)\)
\({n_{hh}} = {n_{HCl}} = 0,2\left( {mol} \right)\)
![]() \(\overline M = {3 \over {0,2}} = 15\)
\(\overline M = {3 \over {0,2}} = 15\)
Nguyên tử khối trung bình là 15 thì phải có một kim loại có NTK < 15 và một kim loại có NTK > 15. Vậy chỉ có Li (M = 7) và Na (M = 23) là phù hợp.
6.3. Chọn C
![]() \({K_2}O + {H_2}O \to 2KOH\)
\({K_2}O + {H_2}O \to 2KOH\)![]() \({{4,7} \over {94}} = 0,05\,\,\,\,\,\,\,\,\,0,1\left( {mol} \right)\)
\({{4,7} \over {94}} = 0,05\,\,\,\,\,\,\,\,\,0,1\left( {mol} \right)\)![]() \(C\% = {{56.0,1} \over {4,7 + 195,3}}.100\% = 2.8\%\)
\(C\% = {{56.0,1} \over {4,7 + 195,3}}.100\% = 2.8\%\)
6.4b. Chọn C
![]() \(2\overline M + {H_2}O \to 2\overline M OH + {H_2}\)
\(2\overline M + {H_2}O \to 2\overline M OH + {H_2}\)![]() \({n_x} = 2{n_{{H_2}}} = 2.{{6,72} \over {22,4}} = 0,6\left( {mol} \right)\)
\({n_x} = 2{n_{{H_2}}} = 2.{{6,72} \over {22,4}} = 0,6\left( {mol} \right)\)![]() \(\overline M = {{17} \over {0,6}} = 28,3\left( {g/mol} \right)\)
\(\overline M = {{17} \over {0,6}} = 28,3\left( {g/mol} \right)\)![]() \(\to Na\left( {M = 23g/mol} \right)\)
\(\to Na\left( {M = 23g/mol} \right)\)![]() \(\to K\left( {M = 39g/mol} \right)\)
\(\to K\left( {M = 39g/mol} \right)\)![]() \({V_{dd\,\,HCl}}{{0,6} \over 2} = 0,3\left( {lit} \right) = 300ml\)
\({V_{dd\,\,HCl}}{{0,6} \over 2} = 0,3\left( {lit} \right) = 300ml\)
Bài 6.5, 6.6, 6.7 trang 55 sách bài tập (SBT) Hóa học 12
6.5. Cho 3,9 g kali tác dụng với nước thu được 100 ml dung dịch. Nồng độ mol của dung dịch KOH thu được là
A. 0,1M.
B. 0,5M.
C. 1M.
D. 0,75M.
6.6. Cho hỗn hợp Na và Mg lấy dư vào 100 g dung dịch H2SO4 20% thì thể tích khí H2 (đktc) thoát ra là
A. 4,57 lít.
B. 54,35 lít.
C. 49,78 lít.
D. 57,35 lít.
6.7. Điện phân nóng chảy muối clorua của một kim loại kiềm thu được 0,896 lít khí (đktc) ở anot và 1,84 g kim loại ở catot. Công thức hoá học của muối là
A. LiCl.
B. NaCl.
C. KCl.
D. RbCl.
Hướng dẫn trả lời:
6.5. C
6.6. B
6.7. B
Bài 6.11 trang 56 sách bài tập (SBT) Hóa học 12
Dung dịch NaOH 20% (D = 1,22 g/cm3) có nồng độ của các ion thế nào? Hãy chọn nồng độ ở cột II để ghép vội ion ở cột I cho phù hợp với dung dịch trên
|
Cột I |
Cột II |
|
a) Nồng độ cation Na+ là: b) Nồng độ anion OH- là: c) Nồng độ cation H+ là:
|
1) 0,61M 2) 6,10 M 3) 1,22M 4) 12,20M 5) 0,164.10-14 M |
Hướng dẫn trả lời:
Chuyển nồng độ C% sang nồng độ CM của dung dịch NaOH được:
CM= 6,10 M
[Na+] = [OH-] = 6,10M
![]() \(\left[ {{H^ + }} \right]{\rm{ }} = {{{{10}^{ - 14}}} \over {{\rm{[}}O{H^ - }{\rm{]}}}} = {{{{10}^{ - 14}}} \over {6,1}} = 0,{164.10^{ - 14}}M\)
\(\left[ {{H^ + }} \right]{\rm{ }} = {{{{10}^{ - 14}}} \over {{\rm{[}}O{H^ - }{\rm{]}}}} = {{{{10}^{ - 14}}} \over {6,1}} = 0,{164.10^{ - 14}}M\)
Nối: a - 2; b - 2, c - 5
Bài 6.12 trang 56 sách bài tập (SBT) Hóa học 12
6.12. Viết cấu hình electron lớp ngoài cùng của các nguyên tố nhóm IA, từ đó suy ra:
a) Trạng thái oxi hoá của các nguyên tố.
b) Kiểu liên kết hoá học trong hầu hết các hợp chất của chúng.
Hướng dẫn trả lời:
Cấu hình e lớp ngoài cùng của nhóm IA: ns1
→ Trạng thái số oxi hóa của các nguyên tố nhóm IA là: +1
→ Kiểu liên kết hóa học trong hầu hết các hợp chất của nó là liên kết ion.
Bài 6.13 trang 56 sách bài tập (SBT) Hóa học 12
Các đại lượng nào sau đây của kim loại kiềm có liên quan với nhau: điện tích hạt nhân, năng lượng ion hoá, bán kính nguyên tử, nhiệt độ nóng chảy, khối lượng riêng? Giải thích ngắn gọn.
Hướng dẫn trả lời:
Điện tích hạt nhân nguyên tử càng nhỏ, bán kính nguyên tử càng lớn, electron liên kết với hạt nhân càng kém chặt chẽ nên càng dễ tách ra khỏi nguyên tử, do đó năng lượng ion hoá nguyên tử càng nhỏ.
Điện tích hạt nhân càng nhỏ, bán kính nguyên tử càng lớn, lực hút của hạt nhân nguyên tử này với lớp vỏ electron của nguyên tử khác ở lân cận nhau càng yếu, các nguyên tử trong tinh thể liên kết với nhau càng kém chặt chẽ, do đó khối lượng riêng của kim loại kiềm nhỏ và nhiệt độ nóng chảy, nhiệt độ sôi của chúng thấp.
Bài 6.14 trang 56 sách bài tập (SBT) Hóa học 12
a) Viết phương trình hoá học chuyển hoá nguyên tử Na thành ion Na+ và ngược lại.
b) Dẫn ra 3 phản ứng hoá học trong đó nguyên tử Na bị oxi hoá thành ion Na+ và 1 phản ứng hoá học trong đó ion Na+ bị khử thành nguyên tử Na.
Hướng dẫn trả lời:
a) Na+ + 1e → Na
b) Phản ứng oxi hóa Na thành Na+: Na tác dụng với phi kim, với dung dịch axit, với nước.
Phản ứng khử Na+ thành Na: Điện phân NaCl hoặc NaOH nóng chảy.
Bài 6.15 trang 56 sách bài tập (SBT) Hoá học 12
a) Điện phân NaOH nóng chảy?
b) Điện phân NaCl nóng chảy?
c) Điện phân dung dịch NaCl?
d) Dung dịch NaOH tác dụng với dung dịch HCl?
Viết phương trình hoá học của các phản ứng đã xảy ra.
Hướng dẫn trả lời:
Na+ bị khử khi điện phân NaOH, NaCl nóng chảy và không bị khử khi điện phân dd NaCl, khi NaOH tác dụng với HCl
![]() \(4NaOH\buildrel {dpnc} \over\longrightarrow 4Na + {O_2} + 2{H_2}O\)
\(4NaOH\buildrel {dpnc} \over\longrightarrow 4Na + {O_2} + 2{H_2}O\)
![]() \(2NaCl\buildrel {dpnc} \over\longrightarrow 2Na + C{l_2}\)
\(2NaCl\buildrel {dpnc} \over\longrightarrow 2Na + C{l_2}\)
![]() \(2NaCl + 2{H_2}O \to 2NaOH + {H_2} + C{l_2}\)
\(2NaCl + 2{H_2}O \to 2NaOH + {H_2} + C{l_2}\)
![]() \(NaOH + HCl \to NaCl + {H_2}O\)
\(NaOH + HCl \to NaCl + {H_2}O\)
Bài 6.16 trang 56 sách bài tập (SBT) Hóa học 12
Viết phương trình hoá học của các phản ứng hoàn thành chuỗi chuyển hoá sau:
![]() \(X\buildrel {\left( 1 \right)} \over\longrightarrow C{l_2}\buildrel {\left( 2 \right)} \over\longrightarrow X\)
\(X\buildrel {\left( 1 \right)} \over\longrightarrow C{l_2}\buildrel {\left( 2 \right)} \over\longrightarrow X\)![]() \(\longrightarrow Y\buildrel {\left( 4 \right)} \over\longrightarrow Z\buildrel {\left( 5 \right)} \over\longrightarrow X\buildrel {\left( 6 \right)} \over\longrightarrow NaN{O_3}\)
\(\longrightarrow Y\buildrel {\left( 4 \right)} \over\longrightarrow Z\buildrel {\left( 5 \right)} \over\longrightarrow X\buildrel {\left( 6 \right)} \over\longrightarrow NaN{O_3}\)
Biết X, Y, Z đều là hợp chất của natri.
Hướng dẫn trả lời:
Theo sơ đồ ta có:
X: NaCl Y: NaOH Z: Na2CO3
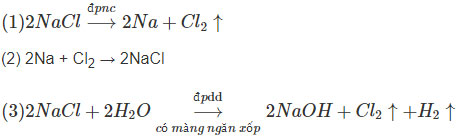
(4) 2NaOH + CO2 → Na2CO3 + H2O
(5) Na2CO3 + 2HCl → 2NaCl + CO2↑ + H2O
(6) NaCl + AgNO3 → NaNO3 + AgCl
Bài 6.17 trang 57 sách bai tập (SBT) Hóa học 12
a) Muốn pha 0,5 lít dung dịch NaOH có pH = 12,5 cần phải dùng bao nhiêu gam NaOH?
b) Để kết tủa hoàn toàn ion Cu2+ trong 200 ml dung dịch CuSO4 có nồng độ 6.10- 3M cần phải dùng bao nhiêu mililít dung dịch NaOH nói trên?
Hướng dẫn trả lời:
a) pH= 12,5 →[H+] = 10 -12,5 → ![]() \({\rm{[}}O{H^ - }{\rm{]}} = {{{{10}^{ - 14}}} \over {{{10}^{ - 12,5}}}} = {10^{ - 1,5}}\)
\({\rm{[}}O{H^ - }{\rm{]}} = {{{{10}^{ - 14}}} \over {{{10}^{ - 12,5}}}} = {10^{ - 1,5}}\)
Mà V=0.5l →n NaOH= [OH-].V=10 -1,5 . 0,5 = 0,0158 mol
→ mNaOH= 0,0158.40=0,632g
b) n CuSO4= 0,2.6.10-3=1,2 .10-3 mol→ n Cu2+ =1,2.10-3 mol
Cu2+ + 2OH- → Cu(OH)2
→ n OH- =2n Cu2+ = 2. 1,2.10-3=2,4.10-3 mol
![]() \({V_{NaOH}} = {{{n_{O{H^ - }}}} \over {{\rm{[}}O{H^ - }{\rm{]}}}} = {{2,{{4.10}^{ - 3}}} \over {{{10}^{ - 1,5}}}} = 0.076l = 76ml\)
\({V_{NaOH}} = {{{n_{O{H^ - }}}} \over {{\rm{[}}O{H^ - }{\rm{]}}}} = {{2,{{4.10}^{ - 3}}} \over {{{10}^{ - 1,5}}}} = 0.076l = 76ml\)
Bài 6.18 trang 57 sách baì tập (SBT) Hóa học 12
Nung nóng 7,26 g hỗn hợp gồm NaHCO3 vào Na2CO3, người ta thu được 0,84 lít khí CO2 (đktc).
Hãy xác định khối lượng của mỗi chất có trong hỗn hợp trước và sau khi nung.
Hướng dẫn trả lời:
Nung hỗn hợp, chỉ có NaHCO3 bị phân hủy:
![]() \(2NaHC{O_3}\buildrel {{t^0}} \over\longrightarrow N{a_2}C{O_3} + {\rm{ }}{H_2}O{\rm{ }} + {\rm{ }}C{O_2}\)
\(2NaHC{O_3}\buildrel {{t^0}} \over\longrightarrow N{a_2}C{O_3} + {\rm{ }}{H_2}O{\rm{ }} + {\rm{ }}C{O_2}\)
Theo (1), ![]() \({n_{NaHC{O_3}}} = 2{n_{C{O_2}}} = 2.{{0,84} \over {22,4}} = 0,075mol\)
\({n_{NaHC{O_3}}} = 2{n_{C{O_2}}} = 2.{{0,84} \over {22,4}} = 0,075mol\)
Trước khi nung:
![]() \({m_{NaHC{O_3}}} = 84.0,075 = 6,3g\)
\({m_{NaHC{O_3}}} = 84.0,075 = 6,3g\)![]() \({m_{N{a_2}C{O_3}}} = 7,26 - 6,3 = 0,96g\)
\({m_{N{a_2}C{O_3}}} = 7,26 - 6,3 = 0,96g\)
Sau khi nung: mNa2CO3= 0,96+106.0,0375=4,935g.
----------------------------------
Để có kết quả cao hơn trong học tập, VnDoc xin giới thiệu tới các bạn học sinh tài liệu Giải bài tập Toán lớp 12, Giải bài tập Hóa học lớp 12, Giải bài tập Vật Lí 12 mà VnDoc tổng hợp và đăng tải.


