Công thức tính nồng độ mol
Tính nồng độ mol
Công thức tính nồng độ mol được VnDoc biên soạn tổng hợp là công thức tính nồng độ mol của các chất, đây là một trong các công thức tính quan trọng các bạn cần ghi nhớ cũng như hiểu bản chất để có thể vận dụng tốt vào các dạng bài tập câu hỏi có liên quan đến tính nồng độ mol. Mời các bạn tham khảo.
1. Công thức tính nồng độ mol
Nồng độ mol của dung dịch cho biết số mol chất tan có trong 1 lít dung dịch
![]() \(C_{M} =\frac{n}{V_{dd} }\)
\(C_{M} =\frac{n}{V_{dd} }\)
Trong đó:
CM là nồng độ mol
n là số mol chất tan
Vdd là thể tích dung dịch (lít)
Từ công thức tính nồng độ mol trên ta có thể suy ra các công thức sau:
Cách tính số mol chất tan trong
n = CM . Vdd
Cách tính thể tích dung dịch
![]() \(V_{dd} =\frac{n}{C_{M} }\)
\(V_{dd} =\frac{n}{C_{M} }\)
2. Công thức tính số mol theo nồng độ phần trăm
![]() \(C_M=\frac{10.D.C\%}M\)
\(C_M=\frac{10.D.C\%}M\)
Trong đó:
M là khối lượng mol
D là khối lượng riêng gam/ml
C% Nồng độ phần trăm
3. Phương pháp tính nồng độ mol nhanh thường được dùng trong dung dịch – Phương pháp sử dụng sơ đồ đường chéo.
Dung dịch 1 có thể tích là V1, khối lượng là m1, nồng độ mol là C1, khối lượng riêng là D1.
Dung dịch 2 có thể tích là V2, khối lượng là m2, nồng độ mol là C2 (C2 > C1), khối lượng riêng là D2.
Ta thu được dung dịch mới có khối lượng m = m1 + m2, thể tích V = V1 + V2, nồng độ mol C (C1 < C < C2) và khối lượng riêng D.
Sơ đồ đường chéo và công thức tương ứng với mỗi trường hợp là:
Đối với nồng độ mol/lít:
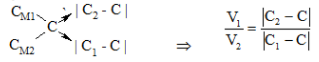
Trong đó: C1, C2, C quy ước là nồng độ mol/lít.
Lưu ý: khi sử dụng sơ đồ đường chéo:
Chất rắn khan xem như dung dịch có C = 100%.
Chất khí tan trong nước mà không phản ứng với nước (HCl, HBr, NH3…) xem như dung dịch có C = 100%.
Dung môi xem như dung dịch có C = 0%.
H2O có khối lượng riêng là d = 1 g/ml.
4. Bài tập tính nồng độ mol
Bài 1: Trong 500ml dung dịch có hòa tan 42 gam NaOH. Tính nồng độ mol NaOH của dung dịch?
Hướng dẫn giải chi tiết
500ml = 0,5 lít
nNaOH = 42/40 = 1.05 mol
Áp dụng công thức tính nồng độ mol ta có:
CM = n/Vdd = 1.05/0,5 = 21 ( M)
Bài 2. Trộn 300 ml dung dịch NaOH 0,2M vào 200 ml dung dịch NaOH 0,6M. Tính nồng độ mol của dung dịch thu được sau khi trộn.
Hướng dẫn giải chi tiết
Số mol NaOH trong 0,2M là: n1 = C1.V1 = 0,2.0,3 = 0,06 mol
Số mol NaOH trong 0,6M là: n2 = C2.V2 = 0,6.0,1 = 0,12 mol
Sau khi trộn hai dung dịch trên ta có:
n = n1 + n2 = 0,18 mol
V = V1 + V2 = 0,51
Nồng độ mol của dung dịch trên là: CM = n/V = 0,18/0,5 = 0,36 mol
Bài 3. Trộn 150ml dung dịch NaOH 2M với 150ml dung dịch NaOH 0,5M thì thu được dung dịch mới có nồng độ mol là?
Hướng dẫn giải chi tiết
Tống số mol NaOH có trong cả 2 dung dịch là
nNaOH = 0,15.2+ 0,15.0,5= 0,375 mol
Nồng độ mol của dung dịch thu được là
CMNaOH = 0,375/0,3 = 1,25 (M)
.................................
VnDoc đã gửi tới nội dung tài liệu Công thức tính nồng độ mol, đây một trong những công thức hóa học quan trọng được vận dụng trong các dạng bài tập hóa học. Hy vọng các bạn học sinh có thể áp dụng tốt vào các dạng bài tập cũng như học tập trên lớp. Mời các bạn cùng tham khảo thêm Hóa lớp 12, Hóa học lớp 11, Hóa học lớp 10.
Ngoài ra các tài liệu trên, VnDoc.com đã thành lập group chia sẻ tài liệu học tập, cũng như bài giảng, giáo án hay miễn phí trên Facebook: Tài Liệu Học Tập VnDoc.com. Mời quý thầy cô cùng các bạn đọc tham gia, để có thể cùng nhau chia sẻ nhận được những tài liệu mới nhất.



