Đề thi học kì 2 môn Hóa học lớp 12 tỉnh Quảng Bình năm học 2014 - 2015
Đề thi học kì 2 môn Hóa học lớp 12 tỉnh Quảng Bình
Đề thi học kì 2 môn Hóa học lớp 12 tỉnh Quảng Bình năm học 2014 - 2015 gồm 30 câu hỏi trắc nghiệm có đáp án đi kèm, là tài liệu ôn tập môn Hóa hữu ích dành cho các bạn học sinh lớp 12, giúp các bạn củng cố và ôn tập kiến thức, từ đó chuẩn bị tốt nhất cho kì thi cuối năm hiệu quả. Mời các bạn tham khảo.
Đề kiểm tra học kì II môn Hóa lớp 12 thành phố Đà Nẵng
| SỞ GD&ĐT QUẢNG BÌNH |
ĐỀ KIỂM TRA HỌC KÌ II – NĂM HỌC 2014 - 2015 MÔN: HÓA HỌC LỚP 12, CHƯƠNG TRÌNH:THPT Thời gian: 45 phút (không kể thời gian giao đề) Đề có 02 trang, gồm có 30 câu MÃ ĐỀ: 01 |
Thí sinh lựa chọn phương án đúng (A, B, C hoặc D) trong các câu sau để trả lời vào phiếu trắc nghiệm
Phần I: Câu 1 đến câu 20 (mỗi câu 0,25đ)
Câu 1. Cho dãy các kim loại: Li, Na, Al, Ca. Số kim loại kiềm trong dãy là
A. 1. B. 3. C. 2. D. 4.
Câu 2. Chất X là một bazơ mạnh, được sử dụng rộng rãi trong nhiều ngành công nghiệp như sản xuất clorua vôi (CaOCl2), vật liệu xây dựng. Ngoài ra chất X còn dùng để xử lí chất thải. Công thức của X là
A. Ba(OH)2. B. Ca(OH)2. C. NaOH. D. KOH.
Câu 3. Cho dãy các oxit: MgO, FeO, CrO3, Cr2O3. Số oxit lưỡng tính trong dãy là
A. 1. B. 4. C. 3. D. 2.
Câu 4. Cho dãy các ion kim loại: K+, Ag+, Fe2+, Cu2+. Ion kim loại có tính oxi hóa mạnh nhất trong dãy là
A. Cu2+. B. K+. C. Ag+. D. Fe2+.
Câu 5. Cho phản ứng của Fe với Oxi như hình vẽ bên. Vai trò của lớp nước ở đáy bình là
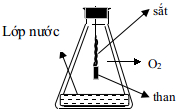
A. Giúp cho phản ứng của Fe với Oxi xảy ra dễ dàng hơn.
B. Hòa tan Oxi để phản ứng với Fe trong nước.
C. Tránh vỡ bình vì phản ứng tỏa nhiệt mạnh.
D. Cả 3 vai trò trên.
Câu 6. Đồng có thể tác dụng với từng chất trong nhóm nào sau đây:
A. H2SO4 đặc, HNO3 loãng, dd Fe2(SO4)3. B. dd Fe2(SO4)3, H2SO4 loãng, khí O2.
C. dd HCl, HNO3 loãng, dd AgNO3. D. H2SO4 loãng, HNO3 đặc, dd FeSO4.
Câu 7. Ở một số địa phương sử dụng nước giếng khoan, khi mới bơm lên nước trong nhưng để lâu thì có mùi tanh và bị ngả màu vàng. Lon làm cho nước có màu vàng là
A. Na+. B. K+. C. Cu2+. D. Fe3+.
Câu 8. Các kim loại bị thụ động hoá với HNO3 đặc, nguội hoặc H2SO4 đặc, nguội là
A. Cr, Fe, Al. B. Al, Fe, Cu. C. Cr, Al, Mg. D. Cr, Fe, Zn.
Câu 9. Cho các hợp kim: Fe–Cu; Fe–C; Zn–Fe; Mg–Fe tiếp xúc với không khí ẩm. Số hợp kim trong đó Fe bị ăn mòn điện hóa là
A. 3. B. 1. C. 4. D. 2.
Câu 10. Cấu hình electron lớp ngoài cùng của nguyên tử kim loại kiềm thổ là
A. ns2np1. B. ns1. C. ns2. D. ns2np2.
Câu 11. Chất có thể làm mềm nước cứng toàn phần là
A. Na2CO3. B. CaCO3. C. CaSO4. D. NaCl.
Câu 12. Cho dãy các kim loại kiềm: Na, Li, Cs, Rb. Kim loại có nhiệt độ nóng chảy thấp nhất là
A. Rb. B. Cs. C. Na. D. Li.
Câu 13. Trong công nghiệp người ta thường điều chế kim loại K bằng cách?
A. Điện phân KCl nóng chảy.
B. Điện phân dung dịch KCl có màng ngăn.
C. Điện phân dung dịch KCl không có màng ngăn.
D. Dùng CO khử K+ trong K2O ở nhiệt độ cao.
Câu 14. Dãy gồm các hợp chất chỉ có tính oxi hoá là
A. Fe(OH)2, FeO. B. FeO, Fe2O3. C. Fe(NO3)2, FeCl3. D. Fe2O3, Fe2(SO4)3.
Câu 15. Chất nào sau đây là nguyên nhân chủ yếu gây ra hiệu ứng nhà kính làm Trái Đất nóng lên:
A. Khí hidroclorua. B. Khí cacbonic. C. Khí clo. D. Khí cacbon oxit.
Câu 16. Điều chế kim loại bằng cách nào dưới đây không thuộc phương pháp nhiệt luyện?
A. 2Al + Cr2O3 → 2Cr + Al2O3. B. CuO + H2 → Cu + H2O.
C. 3CO + Fe2O3 → 2Fe + 3CO2. D. Zn + CuSO4 → ZnSO4 + Cu.
Câu 17. Cho thí nghiệm như hình vẽ bên. Phản ứng xảy ra trong ống nghiệm 2 là
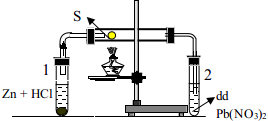
A. Zn + 2HCl → ZnCl2 + H2.
B. H2 + S → H2S.
C. H2S + Pb(NO3)2 → PbS↓ + 2HNO3.
D. 2HCl + Pb(NO3)2 → PbCl2↓ + 2HNO3.
Câu 18. Sắt tây là sắt tráng thiếc. Nếu lớp thiếc bị xước sâu tới lớp sắt thì
A. Kim loại bị ăn mòn trước là thiếc. B. Cả hai đều bị ăn mòn như nhau.
C. Không kim loại nào bị ăn mòn. D. Kim loại bị ăn mòn trước là sắt.
Câu 19. Khi cho bột sắt lần lượt vào các dung dịch sau: FeCl3, AlCl3, CuCl2, Pb(NO3)2, HCl, H2SO4 đặc nóng dư, HNO3 loãng dư. Số trường hợp phản ứng tạo muối sắt (II) là
A. 3. B. 4. C. 5. D. 6.
Câu 20. Để tách lấy Ag ra khỏi hỗn hợp gồm Fe, Cu, Ag ta dùng lượng dư dung dịch
A. HCl. B. HNO3. C. NaOH. D. Fe2(SO4)3.
Phần II: Câu 21 đến câu 30 (mỗi câu 0,5đ)
Câu 21. Cho 5,4 gam Al tác dụng hết với khí Cl2 (dư), thu được m gam muối. Giá trị của m là
A. 26,7. B. 12,5. C. 25,0. D. 19,6.
Câu 22. Khử hoàn toàn hỗn hợp gồm m gam FeO, Fe2O3, Fe3O4 bằng CO dư ở nhiệt độ cao, sau phản ứng thu được 33,6 gam chất rắn và 17,92 lít CO2 (đktc). Giá trị của m là
A. 34,88. B. 36,16. C. 46,40. D. 59,20.
Câu 23. Cho một lá kẽm có khối lượng 8,5 gam vào dung dịch FeSO4, sau phản ứng lấy lá kẽm ra làm khô, cân được 7,6 gam (giả thiết toàn bộ sắt sinh ra bám hết vào lá kẽm). Lượng Zn đã phản ứng là
A. 3,25g. B. 6,5g. C. 13g. D. 8,7g.
Câu 24. Để khử hoàn toàn 8 gam bột Fe2O3 bằng Al ở nhiệt độ cao trong điều kiện không có không khí thì khối lượng bột nhôm tối thiểu cần dùng là
A. 8,1 gam. B. 1,35 gam. C. 2,7 gam. D. 5,4 gam.
Câu 25. Hòa tan hoàn toàn 5,6 gam Fe trong dung dịch HNO3 loãng (dư), thu được dung dịch có chứa m gam muối và khí NO (sản phẩm khử duy nhất). Giá trị của m là
A. 18,0. B. 24,2. C. 42,2. D. 21,1.
Câu 26. Dung dịch chứa x mol FeSO4 và 0,1 mol Fe2(SO4)3 tác dụng với dung dịch NaOH dư, lọc lấy kết tủa nung trong không khí đến khối lượng không đổi thu được 32 gam chất rắn, x có giá trị là
A. 0,2. B. 0,1. C. 0,3. D. 0,4.
Câu 27. Đun nóng m gam hỗn hợp Cu và Fe có tỉ lệ khối lượng tương ứng 7 : 3 với một lượng dung dịch HNO3. Khi các phản ứng kết thúc, thu được 0,75m gam chất rắn, dung dịch X và 5,6 lít hỗn hợp khí (đktc) gồm NO và NO2 (không có sản phẩm khử khác của N+5). Biết lượng HNO3 đã phản ứng là 44,1 gam, m có giá trị gần đúng nhất là
A. 44,8. B. 40,5. C. 33,6. D. 49,6.
Câu 28. Cho 3,68 gam hỗn hợp Al, Zn phản ứng với dung dịch H2SO4 20% (vừa đủ), thu được 0,1 mol H2. Khối lượng dung dịch sau phản ứng là
A. 52,68 gam. B. 52,48 gam. C. 42,58 gam. D. 13,28 gam.
Câu 29. Hoà tan 5,4 gam Al bằng một lượng dung dịch H2SO4 loãng (dư). Sau phản ứng thu được dung dịch X và V lít khí hidro (ở đktc). Giá trị của V là
A. 4,48. B. 3,36. C. 2,24. D. 6,72.
Câu 30. Hấp thụ hoàn toàn 0,672 lít khí CO2 (đktc) vào 1 lít dung dịch gồm NaOH 0,025M và Ca(OH)2 0,0125M, thu được x gam kết tủa, x có giá trị gần đúng nhất là
A. 2,00. B. 1,20 C. 1,00. D. 0,75
(Cho H = 1; C = 12; O = 16; Cl = 35,5; S = 32; Na = 23; Ca = 40; Fe = 56;Zn = 65; Cu = 64; Al = 27)
Đáp án đề thi học kì 2 môn Hóa học lớp 12
Phần I: Câu 1 đến 20: mỗi câu 0,25đ
|
1. C 2. B 3. A 4. C |
5. C 6. A 7. D 8. A |
9. D 10. C 11. A 12. B |
13. A 14. D 15. B 16. D |
17. C 18. D 19. B 20. D |
Phần II: Câu 21 đến câu 30: mỗi câu 0,5đ
|
21. A 22. C |
23. B 24. C |
25. B 26. A |
27. D 28. B |
29. D 30. B |