Đề thi giữa học kì 2 lớp 10 môn Hóa học trường THPT Nguyễn Chí Thanh - TP. HCM

Đề thi giữa kì 2 môn Hóa học lớp 10
VnDoc xin giới thiệu tới bạn đọc Đề thi giữa học kì 2 lớp 10 môn Hóa học năm 2018 - 2019 trường THPT Nguyễn Chí Thanh - TP. HCM. Tài liệu chắc chắn sẽ là nguồn thông tin hữu ích để giúp các bạn học sinh có kết quả cao hơn trong học tập. Mời các bạn tham khảo.
- Đề cương ôn tập học kì 2 lớp 10 môn Toán năm 2018 - 2019 trường THPT Yên Hòa - Hà Nội
- Bộ đề thi học kì 1 lớp 10 môn Toán năm 2017 - 2018
- 10 bộ đề thi học kì 1 môn Toán lớp 10
- Đề thi học kì 1 lớp 10 môn Toán năm 2018 - 2019 trường THPT Đoàn Kết - Hà Nội
- Đề thi học kì 1 lớp 10 môn Toán năm 2018 - 2019 trường THPT Nguyễn Trãi - Hà Nội
- Đề thi học kì 1 lớp 10 môn Hóa học năm 2018 - 2019 trường THPT Nguyễn Viết Xuân - Vĩnh Phúc
| SỞ GIÁO DỤC & ĐÀO TẠO TpHCM TRƯỜNG THPT NGUYỄN CHÍ THANH |
ĐỀ KIỂM TRA GIỮA HỌC KÌ II - NĂM HỌC 2018-2019 MÔN HÓA HỌC 10 Thời gian làm bài: 45 phút (không kể thời gian phát đề) |
Học sinh ban Tự nhiên giải các câu: 1, 2, 3, 4, 7, 8.
Học sinh ban Xã hội giải các câu: 1, 2, 3, 4, 5, 6.
Cho nguyên tử khối: Al= 27; Fe = 56; Mg = 24, Zn =65; Ca = 40; Ba = 137; Mn = 55; O=16; H = 1; Cl=35,5.
A. PHẦN CHUNG
Câu 1. (2,0đ) Viết phương trình hóa học của các phản ứng trong hai sơ đồ chuyển hóa sau:
Sơ đồ 1: KMnO4 Cl2
CaOCl2
CaCO3
CaCl2
Sơ đồ 2: Cl2 Br2
AlBr3
AgBr
Ag
Câu 2. (2,0đ) Viết phương trình phản ứng hóa học chứng minh các nhận định sau:
a) O2 có tính oxi hóa (ghi rõ số oxi hóa).
b) Cl2 vừa có tính khử, vừa có tính oxi hóa (ghi rõ số oxi hóa).
c) HF có thể ăn mòn thủy tinh.
d) O3 có tính oxi hóa mạnh hơn O2.
Câu 3. (1,0đ) Nêu hiện tượng và viết phương trình hóa học xảy ra trong các thí nghiệm sau:
a) Dẫn khí clo vào dung dịch KI có nhỏ hồ tinh bột.
b) Cho Zn vào dung dịch HCl.
Câu 4. (1,0đ) Từ nguyên liệu là nước, muối ăn, sắt, các dụng cụ thí nghiệm cần thiết có đủ, viết phương trình phản ứng điều chế sắt(II) hiđroxit.
B. PHẦN RIÊNG
PHẦN DÀNH CHO BAN XÃ HỘI (CÁC LỚP TỪ 10A1 ĐẾN 10A4):
Câu 5. (1,5đ) Cho 3,6 gam kim loại R (thuộc nhóm IIA) tan hết trong dung dịch HCl tạo thành 3,36 lít khí H2 (đkc). Xác định tên của R.
Câu 6. (2,5 đ) Cho 11 gam hỗn hợp X gồm Al và Fe tan hết trong m gam dung dịch HCl 14,6% (vừa đủ) thu được 8,96 lít H2 (đkc).
a) Tính khối lượng mỗi kim loại trong X.
b) Tính giá trị của m.
PHẦN DÀNH CHO BAN TỰ NHIÊN (CÁC LỚP TỪ 10A5 ĐẾN 10A16):
Câu 7. (1,5 điểm) Clo hóa hoàn toàn 13 gam một kim loại X chưa biết hóa trị cần dùng hết 4,48 lít khí clo (đktc).
a) Xác định tên của X.
b) Cần bao nhiêu gam MnO2 tác dụng vừa đủ với dung dịch HCl đặc để điều chế lượng clo đã dùng khi hiệu suất phản ứng là 75%.
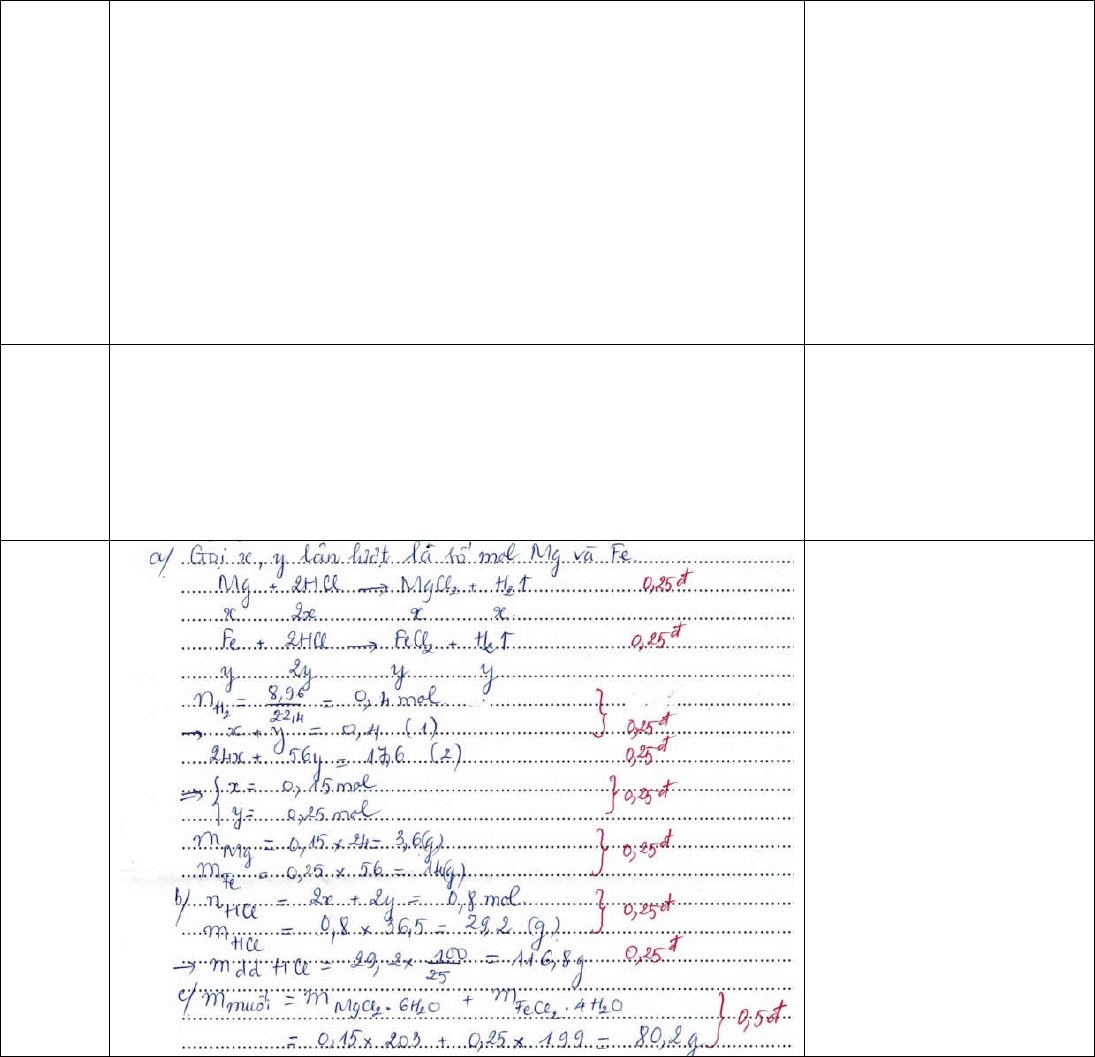
Câu 8. (2,5đ) Hòa tan hoàn toàn 17,6 gam hỗn hợp gồm Mg và Fe vừa đủ trong m gam dung dịch HCl 25%. Sau phản ứng thu được dung dịch X và 8,96 lít khí H2 (đktc).
a) Tính khối lượng mỗi kim loại trong hỗn hợp ban đầu.
b) Tính m.
c) Tính khối lượng muối thu được khi cô cạn dung dịch X, biết thực tế các muối kết tinh dưới dạng MgCl2.6H2O và FeCl2.4H2O.
Xem đáp án hướng dẫn giải chi tiết dưới link TẢI VỀ miễn phí bên dưới
---------- Hết -----------
Trên đây VnDoc đã giới thiệu tới các bạn Đề thi giữa học kì 2 lớp 10 môn Hóa học năm 2018 - 2019 trường THPT Nguyễn Chí Thanh - TP. HCM. Để có kết quả cao hơn trong học tập, VnDoc xin giới thiệu tới các bạn học sinh tài liệu Giải bài tập Toán 10, Giải bài tập Vật Lí 10, Giải bài tập Sinh học 10, Giải bài tập Hóa học 10, Tài liệu học tập lớp 10 mà VnDoc tổng hợp và đăng tải.
Ngoài ra, VnDoc.com đã thành lập group chia sẻ tài liệu học tập THPT miễn phí trên Facebook, mời bạn đọc tham gia nhóm Tài liệu học tập lớp 10 để có thể cập nhật thêm nhiều tài liệu mới nhất.


