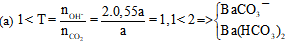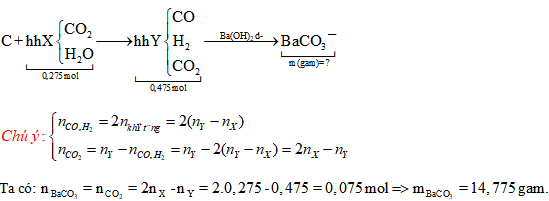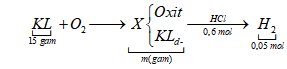Đề thi thử THPT Quốc gia năm 2020 môn Hóa học Sở GD&ĐT Thái Nguyên



Đề thi thử THPT Quốc gia năm 2020 môn Hóa học Sở GD&ĐT Thái Nguyên được VnDoc tổng hợp, biên soạn kèm đáp án, hướng dẫn lời giải chi tiết. Nội dung bám sát cấu trúc đề thi THPT Quốc gia.
Giúp các bạn làm quen luyện tập với các dạng bài tập, câu hỏi xuất hiện trong đề thi cũng như đánh giá năng lực, chuẩn bị cho kì thi THPT quốc gia môn Hóa học.
Ngoài ra các bạn có thể tham khảo thêm một số đề thi thử năm 2020 môn Hóa học mới nhất của các trường THPT
Đề thi thử THPT Quốc gia năm 2020 môn Hóa học Sở GD&ĐT Thái Nguyên
Đáp án đề thi thử THPT Quốc gia năm 2020 môn Hóa học Sở GD&ĐT Thái Nguyên
Giải chi câu hỏi khó trong đề thi thử THPT Quốc gia năm 2020 môn Hóa học Sở GD&ĐT Thái Nguyên
Câu 48: Kim loại Cu tác dụng được với dung dịch nào dưới đây?
A. AgNO3.
B. AlCl3.
C. FeCl2.
D. Zn(NO3)2.
|
Hướng dẫn giải Cu + 2AgNO3 → Cu(NO3)2 + 2Ag Áp dụng tính chất của muối. Kim loại mạnh hơn đẩy kim loại yếu ra khỏi dung dịch muối của chúng |
Câu 53: Một mẫu khí thải công nghiệp có nhiễm khí H2S. Cho mẫu khí đó qua dung dịch Pb(NO3)2 thấy xuất hiện kết tủa màu
A. xanh.
B. vàng.
C. đen.
D. trắng.
|
Hướng dẫn giải H2S + Pb(NO3)2 → HNO3 + PbS↓ (đen) |
Câu 61: Thực hiện các thí nghiệm sau:
(a) Sục từ từ a mol khí CO2 vào dung dịch chứa 0,55a mol Ba(OH)2
(b) Sục từ từ khí CO2 đến dư vào dung dịch NaAlO2.
(c) Cho dung dịch NaHCO3 vào dung dịch Ca(OH)2.
(d) Cho AgNO3 vào dung dịch Fe(NO3)2 dư.
(e) Cho Mg vào dung dịch FeCl3 dư.
Sau khi các phản ứng kết thúc, số thí nghiệm tạo thành chất kết tủa là
A. 2.
B. 4.
C. 3.
D. 5.
|
Hướng dẫn giải
(b) NaAlO2 + CO2 dư + H2O → Al(OH)3↓ + NaHCO3 (c) 2NaHCO3 + Ca(OH)2 → CaCO3↓ + Na2CO3 + 2H2O (d) AgNO3 + Fe(NO3)2 → Fe(NO3)3 + Ag↓ (e) Mg + 2FeCl3 dư → MgCl2 + 2FeCl2 |
Câu 62: Lên men 22,5 gam glucozơ để điều chế ancol etylic với hiệu suất 80%, thu được V lít khí CO2. Giá trị của V là
A. 2,24.
B. 5,60.
C. 1,12.
D. 4,48.
|
Hướng dẫn giải PTHH: C6H12O6 0,125 |
Câu 63: Dẫn 0,275 mol hỗn hợp X gồm hơi nước và khí CO2 qua cacbon nung đỏ, thu được 0,475 mol hỗn hợp Y gồm CO, H2, CO2. Cho Y hấp thụ vào dung dịch chứa Ba(OH)2 dư, sau phản ứng thu được m gam kết tủa. Giá trị của m là
A. 14,775.
B. 12,805.
C. 9,85.
D. 19,7.
|
Hướng dẫn giải
|
Câu 65: Cho m gam bột Cu tác dụng hoàn toàn với dung dịch AgNO3 dư, thu được 16,2 gam Ag. Giá trị của m là
A. 3,20.
B. 6,40.
C. 1,60.
D. 4,80.
|
Hướng dẫn giải PTHH: Cu + 2AgNO3 → Cu(NO3)2 + 2Ag 0,075 ← 0,15 mol ⇒ mCu = 4,8 gam. |
Câu 66: Cho 15 gam hỗn hợp Fe, Zn, Mg tác dụng với O2 ở nhiệt độ cao, sau một thời gian thu được m gam hỗn hợp rắn X. Lượng chất rắn X phản ứng vừa đủ với 300 ml dung dịch HCl 2M, thu được 1,12 lít khí bay ra. Giá trị của m là
A. 15,8.
B. 17,4.
C. 19,8.
D. 19,0.
|
Hướng dẫn giải
Bảo toàn H ta có: nH2O = 0,25 mol => nO = 0,25 mol=> mX = mkim loại + mO= 19 gam |
Câu 67: Đun nóng natri axetat khan (CH3COONa) với hỗn hợp natri hiđroxit (NaOH) và canxi oxit (CaO). Hiđrocacbon sinh ra trong thí nghiệm trên là
A. propilen.
B. metan.
C. axetilen.
D. etilen.
|
Hướng dẫn giải PTHH: CH3COONa + NaOH → CH4↑ + Na2CO3 |
Câu 69: Hòa tan hoàn toàn 0,2 mol Al bằng dung dịch KOH dư, thu được V lít H2. Giá trị của V là
A. 4,48.
B. 6,72.
C. 3,36.
D. 5,60.
|
Hướng dẫn giải PTHH: Al + KOH + H2O → KAlO2 + H2↑ 0,2 → 0,3 (mol) ⇒ V = 6,72 lít. |
Câu 72: Cho các phát biểu sau:
(a) Isoamyl axetat có mùi chuối chín, dễ tan trong nước được dùng làm chất tạo mùi thơm trong công nghiệp thực phẩm.
(b) Xenlulozơ trinitrat là nguyên liệu để sản xuất tơ nhân tạo và chế tạo thuốc súng không khói.
(c) Khi nấu canh cua, hiện tượng riêu cua nổi lên trên là do sự đông tụ protein.
(d) Tơ nilon bền đối với nhiệt, axit, kiềm.
(e) Liên kết peptit là liên kết -CO-NH- giữa hai đơn vị α-amino axit.
Số phát biểu đúng là
A. 3.
B. 5.
C. 2.
D. 4.
|
Hướng dẫn giải (a) Sai vì este không tan trong nước; (b) Sai vì để sản xuất tơ nhân tạo phải từ xenlulozơ. (d) Sai vì tơ nilon chứa các liên kết amin (CO - NH) dễ bị thủy phân trong môi trường axit và kiềm. |
Câu 74: Cho 22,56 gam Ala-Val tác dụng hết với dung dịch KOH dư, đun nóng. Số mol KOH đã phản ứng là
A. 0,1.
B. 0,24.
C. 0,12.
D. 0,2.
|
Hướng dẫn giải nAla -Val = 22,56 : (89 + 117 -18)= 0,12 mol PTHH: Ala – Val + 2KOH → AlaK + ValK + H2O 0,12 → 0,24 mol |
Để tham khảo đầy đủ chi tiết nội dung tài liệu, vui lòng ấn tải link bên dưới
Trên đây VnDoc đã giới thiệu Đề thi thử THPT Quốc gia năm 2020 môn Hóa học Sở GD&ĐT Thái Nguyên tới bạn đọc. Để có kết quả cao hơn trong kì thi, VnDoc xin giới thiệu tới các bạn học sinh tài liệu Thi thpt Quốc gia môn Toán, Thi THPT Quốc gia môn Hóa học, Thi THPT Quốc gia môn Vật Lý, Thi THPT Quốc gia môn Sinh học, mà VnDoc tổng hợp và đăng tải.
Ngoài ra, VnDoc.com đã thành lập group chia sẻ tài liệu ôn tập THPT Quốc gia miễn phí trên Facebook: Quyết tâm đỗ Đại Học Mời các bạn học sinh tham gia nhóm, để có thể nhận được những tài liệu, đề thi mới nhất.