Hóa học 8 Bài 23: Bài luyện tập số 4
Hóa học 8 Bài 23: Bài luyện tập số 4 được VnDoc biên soạn, là nội dung Hóa 8 bài 23. Nội dung tài liệu tóm tắt, tổng hợp lại các công thức cũng như các dạng bài tập các em đã được học trước đó, từ đó vận dung làm các dạng bài tập trong bài luyện tập số 4. Bên cạnh đó kèm theo các dạng bài tập nâng cao mở rộng giúp các em được luyện tập nâng cao hơn.
Hy vọng qua Bài 23 Hóa học 8 sẽ giúp các bạn học sinh nắm chắc kiến thức cũng như các công thức đã được học. Tài liệu còn rất hữu ích với quý thầy cô dùng làm tài liệu tham khảo trong quá trình soạn giảng. Mời các bạn tham khảo.
I. Tóm tắt kiến thức cần nhớ
1. Mol
- Khái niệm mol: Mol là lượng chất chứa 6.1023 nguyên tử hoặc phân tử của chất đó.
6.1023 được gọi là số Avogađo
Được kí hiệu là N
Vi dụ: 1 mol nguyên tử Na có chứa 6.1023 nguyên tử Na
0,7 mol phân tử NaCl có chứa 0,7. 6.1023 nguyên tử NaCl ( 4,2.1023 )
2. Khối lượng mol
- Kí hiệu M là khối lượng một chất theo gam của N nguyên tử, phân tử chất đó
- Khối lượng mol của M có giá trị tuyệt đối với nguyên tử khối phân tử khối của chất đó
Ví dụ: Khối lượng mol của NaCl: MNaCl = 23.1 + 1.1 = 58,5 (g/mol)
3. Thể tích mol
- Thể tích mol của 1 chất khí là thể tích chiếm bởi N nguyên tử/phân tử (1 mol nguyên/phân tử) của chất khí đó là kí hiệu là V.
- Xét cùng điều kiện nhiệt độ và áp suất, 1 mol chất khí bất kì đều chiếm những thể tích bằng nhau.
Ví dụ: Ở điều kiện tiêu chuẩn
+ MO2 = 32 (g/mol), MH2 = 2 (g/mol), MHCl = 36,5 (g/mol)
+ VO2 = VH2 = VHCl = 22,4 lít
Mối quan hệ giữa khối lượng, thể tích và lượng chất.
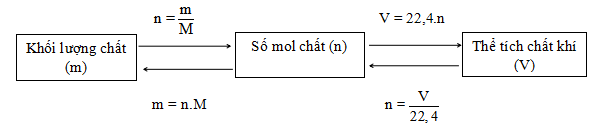
4. Tỉ khối chất khí
Tỉ khối chất khí của khí A so với chất khí B được tính theo công thức
![]() \({d_{A/B}} = \frac{{{M_A}}}{{{M_B}}}\)
\({d_{A/B}} = \frac{{{M_A}}}{{{M_B}}}\)
Tỉ khối của chất khí so với không khí
![]() \({d_{A/kk}} = \frac{{{M_A}}}{{{M_{kk}}}} = \frac{{{M_A}}}{{29}}\)
\({d_{A/kk}} = \frac{{{M_A}}}{{{M_{kk}}}} = \frac{{{M_A}}}{{29}}\)
II. Bài tập vận dụng, mở rộng
Câu 1. Hãy tìm công thức hóa học của hợp chất X có khối lượng mol MX = 197 (g/mol), thành phần các nguyên tố theo khối lượng: 69,54%Ba, 6,09%C còn lại là O
Câu 2. Amoniac NH3 là một chất khí tan nhiều trong nước và có mùi khai đặc trưng. Amoniac có thể được tổng hợp từ phản ứng giữa N2 và H2.
a) Viết phương trình hóa học phản ứng tổng hợp NH3
b) Thể tích khí amoniac (đktc) sinh ra khi cho 1 mol N2 phản ứng
Câu 3. Hòa tan 16,25 gam Zn vào dung dịch HCl dư thu được muối ZnCl2 và khí hidro.
a) Viết phương trình hóa học của phản ứng.
b) Thể tích khí hidro (đktc) sau phản ứng trên.
Câu 4. Đốt cháy hoàn toàn 4,65 gam Photpho trong không khí thu được hợp chất điphotpho pentaoxit P2O5.
a) Viết phương trình hóa học phản ứng.
b) Tính thể tích không khí cần dùng cho phản ứng trên, biết rằng khí oxi chiếm 20% về thành phần không khí.
Câu 5. Hòa tan 5,6 gam một kim loại R có hóa trị II vào dung dịch HCl thu được muối clocrua và 2,24 lít khí H2 thoát ra (ở đktc).
a) Xác định tên kim loại R
b) Tính khối lượng muối thu được sau phản ứng.
III. Hướng dẫn giải bài tập
Câu 1.
%mO = 100% - 69,54% - 6,09% = 24,37%
 \(\begin{array}{l}
{m_{Ba}} = \frac{{69,54.197}}{{100}} = 137gam\\
{m_C} = \frac{{6,09.197}}{{100}} = 12 gam \\
{m_O} = \frac{{24,37.197}}{{100}} = 48 gam
\end{array}\)
\(\begin{array}{l}
{m_{Ba}} = \frac{{69,54.197}}{{100}} = 137gam\\
{m_C} = \frac{{6,09.197}}{{100}} = 12 gam \\
{m_O} = \frac{{24,37.197}}{{100}} = 48 gam
\end{array}\)
Số mol nguyên tử của mỗi nguyên tố trong 1 mol hợp chất:
![]() \({n_{Ba}} = \frac{{137}}{{137}} = {1^{}}mol ; {n_C} = \frac{{12}}{{12}} = 1 mol ; {n_O} = \frac{{48}}{{16}} = 3 mol\)
\({n_{Ba}} = \frac{{137}}{{137}} = {1^{}}mol ; {n_C} = \frac{{12}}{{12}} = 1 mol ; {n_O} = \frac{{48}}{{16}} = 3 mol\)
Trong 1 phân tử hợp chất khí trên có: 1mol nguyên tử Ba; 1 mol nguyên tử C và 3 mol nguyên tử O.
Công thức hóa học của hợp chất trên là BaCO3
Câu 2.
Phương trình hóa học của phản ứng tổng hợp NH3:
N2 + 3H2 ![]() \(\overset{t^{\circ } }{\rightarrow}\) 2NH3
\(\overset{t^{\circ } }{\rightarrow}\) 2NH3
Xét phương trình: N2 + 3H2 ![]() \(\overset{t^{\circ } }{\rightarrow}\) 2NH3
\(\overset{t^{\circ } }{\rightarrow}\) 2NH3
Theo PTHH: 1 mol 2 mol
Theo đề bài: 1 mol ![]() \(\frac{{1.2}}{1} = 2(mol)\)
\(\frac{{1.2}}{1} = 2(mol)\)
Từ phương trình hóa học số mol NH3 bằng 1 mol
Thể tích khí NH3 sinh ra bằng: VNH3 = nNH3.22,4 = 2.22,4 = 44,8 lít
Câu 3.
Phương trình hóa học của phản ứng:
Zn + 2HCl → ZnCl2 + H2
Số mol của Zn bằng:
![]() \({n_{Zn}} = \frac{{{m_{Zn}}}}{{{M_{Zn}}}} = \frac{{16,25}}{{65}} = 0,25(mol)\)
\({n_{Zn}} = \frac{{{m_{Zn}}}}{{{M_{Zn}}}} = \frac{{16,25}}{{65}} = 0,25(mol)\)
Xét phương trình: Zn + 2HCl → ZnCl2 + H2
Theo PTHH: 1 mol 1 mol
Theo đề bài: 0,25 → 0,25 mol
Từ phương trình hóa học số mol H2 bằng: nH2 = 0,25 mol
Thể tích khí H2 sinh ra bằng: VH2 = nH2.22,4 = 0,25.22,4 = 5,6 lít
Câu 4.
Phương trình hóa học phản ứng
4P + 5O2 ![]() \(\overset{t^{\circ } }{\rightarrow}\) 2P2O5
\(\overset{t^{\circ } }{\rightarrow}\) 2P2O5
Tính số mol của photpho:
![]() \({n_P} = \frac{{{m_P}}}{{{M_P}}} = \frac{{4,65}}{{31}} = 0,15(mol)\)
\({n_P} = \frac{{{m_P}}}{{{M_P}}} = \frac{{4,65}}{{31}} = 0,15(mol)\)
Xét phản ứng: 4P + 5O2 ![]() \(\overset{t^{\circ } }{\rightarrow}\)2P2O5
\(\overset{t^{\circ } }{\rightarrow}\)2P2O5
Theo PTHH: 4mol 5mol
Theo đề bài: 0,15 mol → ![]() \(\frac{{0,15.5}}{4} = 0,1875(mol)\)
\(\frac{{0,15.5}}{4} = 0,1875(mol)\)
Từ phương trình hóa học ta có: nO2 = 0,1875 mol
Thể tích khí oxi bằng: VO2 = nO2.22,4 = 0,1875.22,4 = 4,2 lít
Ta có oxi chiếm 20% thể tích không khí => Vkk = 5.VO2 = 5. 4,2 = 21 lít
Câu 5.
Phương trình hóa học tổng quát:
R + 2HCl → RCl2 + H2
Số mol của H2 bằng:
![]() \({n_{{H_2}}} = \frac{V}{{22,4}} = \frac{{2,24}}{{22,4}} = 0,1(mol)\)
\({n_{{H_2}}} = \frac{V}{{22,4}} = \frac{{2,24}}{{22,4}} = 0,1(mol)\)
Xét phương trình: R + 2HCl → RCl2 + H2
Theo PTHH: 1 mol 1 mol
Theo đề bài: 0,1 mol ← 0,1mol
Từ phương trình hóa học số mol R bằng: nR = 0,1 mol
Khối lượng mol của kim loại R bằng:
![]() \({M_R} = \frac{{{m_R}}}{{{n_R}}} = \frac{{5,6}}{{0,1}} = 56(g/mol)\)
\({M_R} = \frac{{{m_R}}}{{{n_R}}} = \frac{{5,6}}{{0,1}} = 56(g/mol)\)
Vậy R có khối lượng mol bằng 56 tra bảng SGk/42 kim loại đó là Fe.
...................
Mời các bạn tham khảo một số tài liệu liên quan:
- Giải bài tập trang 79 SGK Hóa lớp 8: Bài luyện tập 4 - Mol và tính hóa học
- Hóa học 8 Bài 24: Tính chất của oxi
Để có kết quả cao hơn trong học tập, VnDoc xin giới thiệu tới các bạn học sinh tài liệu Chuyên đề Toán 8, Chuyên đề Vật Lý 8, Chuyên đề Hóa 8, Tài liệu học tập lớp 8 mà VnDoc tổng hợp và đăng tải.
Ngoài ra, VnDoc.com đã thành lập group chia sẻ tài liệu học tập THCS miễn phí trên Facebook: Tài liệu học tập lớp 8. Mời các bạn học sinh tham gia nhóm, để có thể nhận được những tài liệu mới nhất.








