Hóa học 8 Bài 34: Bài luyện tập 6
Hóa học 8 Bài 34: Bài luyện tập số 6 được VnDoc biên soạn là nội dung tóm tắt lại các bài được học trước đó trong chương 5 giúp ôn tập, củng cố cũng như luyện cho các bạn học sinh các thao tác giải các dạng bài tập.
Hóa 8 Bài 34
Hy vọng với tài liệu này giúp các bạn học sinh học nắm chắc kiến thức hơn cũng như giúp ích cho quý thầy cô trong quá trình soạn giảng Hóa 8 bài 34 của mình. Mời các bạn tham khảo.
I. Tóm tắt lý thuyết hóa 8 bài 34
1. Khí hiđro có tính khử, ở nhiệt độ thích hợp kết hợp được với đơn chất oxi, một số oxit kim loại
2H2 + O2 ![]() \(\overset{t^{\circ } }{\rightarrow}\) 2H2O
\(\overset{t^{\circ } }{\rightarrow}\) 2H2O
CuO + H2 ![]() \(\overset{t^{\circ } }{\rightarrow}\) Cu + H2O
\(\overset{t^{\circ } }{\rightarrow}\) Cu + H2O
2. Ứng dụng, chủ yếu do tính chất rất nhẹ (nhẹ nhất trong các chất khí), tính khử và khi cháy tỏa nhiều nhiệt.
3. Điều chế khí hiđro
Trong phòng thí nghiệm: cho dung dịch axit HCl hoặc H2SO4 loãng tác dụng với kim loại như: Zn, Fe, Al
2HCl + Zn → ZnCl2 + H2
Thu khí hiđro bằng 2 cách: đẩy không khí hoặc đẩy nước
4. Phản ứng thế là phản ứng hóa học giữa đơn chất và hợp chất, trong đó nguyên tử của đơn chất thay thế nguyên tử của một nguyên tố trong hợp chất.
Zn + H2SO4 → ZnSO4 + H2
II. Bài tập luyện tập mở rộng
Câu 1. Trong công nghiệp có thể điều chế hiđro bằng cách nào
A. Điện phân nước
B. Cho Cu tác dụng với dung dịch H2SO4 đặc, nóng
C. Cho Al tác dụng với dung dịch HNO3 đặc, nóng
D. Cho Fe tác dụng với dung dịch H2SO4 loãng
Câu 2. Phản ứng hóa học nào dưới đây thuộc phản ứng thế
A. CaO + H2O![]() \(\overset{t^{\circ } }{\rightarrow}\) Ca(OH)2
\(\overset{t^{\circ } }{\rightarrow}\) Ca(OH)2
B. 2KClO3 ![]() \(\overset{t^{\circ } }{\rightarrow}\) 2KCl + 3O2
\(\overset{t^{\circ } }{\rightarrow}\) 2KCl + 3O2
C. SO2 + Ba(OH)2 → BaSO3 + H2O
D. Fe + H2SO4 (loãng) → FeSO4 + H2
Câu 3. Dãy chất nào có thể phản ứng được với hiđro
A. Na2O, CaO, O2
B. Al2O3, ZnO, Cl2
C. O2, Cl2, CuO
D. Cu, Al2O3, Br2
Câu 4. Có thể nhận biết được khí hidro thoát ra bằng cách nào
A. Dẫn khí hidro qua dung dịch nước vôi trong
B. Đốt khí trên đầu ống dẫn khí vuốt nhọn cho ngọn lửa màu xanh nhạt.
C. Cho giấy quỳ tím vào bình đựng khí.
D. Dẫn khí hidro qua ống nghiệm đựng bột đồng (II) oxit ở nhiệt độ thường.
Câu 5. Tại sao khi điều chế khí hidro trong phòng thí nghiệm, người ta sử dụng phương pháp đẩy nước
A. Khí oxi tan nhiều trong nước
B. Khí oxi ít tan trong nước
C. Khí oxi nặng hơn không khí
D. Khí oxi không tan được trong nước
Câu 6. Cho 14 gam Fe tác dụng hết với dung dịch axit clohidric H2SO4 loãng dư, sau phản ứng thu được V (lít) khí H2 (đktc). Giá trị của V
A. 5,6 lít
B. 8,4 lít
C. 2,24 lít
D. 4,48 lít
Câu 7. Điện phân 5,4 gam nước trong bình điện phân, thể tích khí hiđro thu được (đktc) lần lượt là:
A. 1,12 lít
B. 6,72 lít
C. 2,24 lít
D. 4,48 lít
Câu 8. Khí hiđro cháy trong không khí với ngọn lửa
A. vàng
B. đỏ
C. Xanh nhạt
D. Không màu
Câu 9. Hòa tan hoàn toàn 9,75 một kim loại M có hóa trị II vào dung dịch HCl dư, sau phản ứng thu được 3,36 gam khí H2 (đktc). Xác định kim loại M
A. Cu
B. Fe
C. Ba
D. Zn
Câu 10. Cho hình vẽ sau:
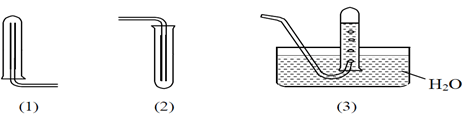
1. Cách 1 có thể áp dụng thu khí nào sau đây?
A. Khí CO2
B. Khí O2
C. Khí SO2
D. KHí H2
2. Cách 2 có thể áp dụng để thu khí nào dưới đây?
A. Khí CO2
B. Khí CH4
C. Khí H2
D. Khí N2
3. Cách 3 có thể áp dụng để thu khí nào dưới đây?
A. Khí NH3
B. Khí H2
C. Khí HCl
D. Khí SO2
III. Đáp án - Hướng dẫn giải câu hỏi trắc nghiệm
| Câu 1 | Câu 2 | Câu 3 | Câu 4 | Câu 5 |
| A | D | D | B | B |
| Câu 6 | Câu 7 | Câu 8 | Câu 9 | Câu 10 |
| A | B | C | D | D,A,B |
Câu 6.
Số mol của Fe bằng: nFe = 14/56 = 0,25 mol
PTHH: Fe + H2SO4 → FeSO4 + H2
Theo PTHH: 1 mol 1 mol
Theo đề bài: 0,25 mol → 0,25 mol
Dựa vào phương trình phản ứng ta có nH2 = 0,25 mol => VH2 = 0,25.22,4 = 5,6 lít
Câu 7.
Số mol của H2O = 5,4/18 = 0,3 mol
PTHH: 2H2O→ O2 + 2H2
Theo PTHH: 2 mol 2 mol
Theo đề bài: 0,3 mol → 0,3 mol
Dựa vào phương trình phản ứng ta có nH2 = 0,3 mol => VH2 = 0,3.22,4 = 6,72 lít
Câu 9.
Số mol khí H2 bằng: nH2 = 3,36/22,4 = 0,15 (mol)
PTHH: M + 2HCl → MCl2 + H2
Theo PTHH: 1 mol 1 mol
Theo đề bài: 0,15 mol ← 0,15 mol
Dựa vào phương trình phản ứng ta có nM = 0,15 mol => MM = 9,75/0,15 = 65 (g/mol)
=> Kim loại M cần tìm là Zn
................................
Mời các bạn tham khảo thêm một số tài liệu liên quan:
- Hóa học 8 Bài 35: Bài thực hành số 5 Điều chế - Thu khí hiđro và thử tính chất của khí hiđro
- Giải bài tập trang 118, 119 SGK Hóa lớp 8: Bài luyện tập 6
- Trắc nghiệm Hóa học 8 bài 34
Để có kết quả cao hơn trong học tập, VnDoc xin giới thiệu tới các bạn học sinh tài liệu Chuyên đề Toán 8, Chuyên đề Vật Lý 8, Chuyên đề Hóa 8, Tài liệu học tập lớp 8 mà VnDoc tổng hợp và đăng tải.
Ngoài ra, VnDoc.com đã thành lập group chia sẻ tài liệu học tập THCS miễn phí trên Facebook: Tài liệu học tập lớp 8. Mời các bạn học sinh tham gia nhóm, để có thể nhận được những tài liệu mới nhất.








