Hóa học 8 Bài 27: Điều chế khí oxi - Phản ứng phân hủy
Hóa học 8 Bài 27: Điều chế khí oxi - Phản ứng phân hủy được VnDoc biên soạn trọng tâm nội dung Bài 27, bên cạnh đó mở rộng đi sau vào phần dạng bài tập câu hỏi trắc nghiệm. Giúp các em có thể nắm được bài một cách dễ hiểu nhất.
Hóa 8 Bài 27
Hy vọng qua tài liệu này sẽ giúp các bạn học sinh nắm được cách điều chế oxi trong phòng thí nghiệm cũng như trong công nghiệp và cũng hiểu thế nào là phản ứng phân hủy. Từ đó làm các câu hỏi bài tập. Mời các bạn tham khảo.
I. Tóm tắt kiến thức cần nhớ
1. Điều chế khí oxi trong phòng thí nghiệm
Điều chế oxi trong phòng thí nghiệm bằng cách đun nóng những hợp chất giàu oxi dễ bị phân hủy ở nhiệt độ cao.
Ví dụ
2KClO3 ![]() \(\overset{t^{\circ } }{\rightarrow}\) 2KCl + 3O2
\(\overset{t^{\circ } }{\rightarrow}\) 2KCl + 3O2
2KMnO4 ![]() \(\overset{t^{\circ } }{\rightarrow}\) K2MnO4 + MnO2 + O2
\(\overset{t^{\circ } }{\rightarrow}\) K2MnO4 + MnO2 + O2
2. Điều chế oxi trong công nghiệp
a. Sản xuất oxi từ không khí
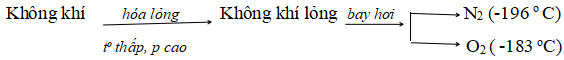
b. Sản xuất từ nước
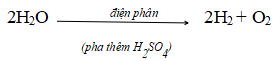
3. Phản ứng phân hủy
Định nghĩa:
Phản ứng phân hủy là phản ứng hóa học trong đó một chất sinh ra hai hay nhiều chất mới.
Ví dụ:
CaCO3 ![]() \(\overset{t^{\circ } }{\rightarrow}\)CaO + CO2
\(\overset{t^{\circ } }{\rightarrow}\)CaO + CO2
2KClO3 ![]() \(\overset{t^{\circ } }{\rightarrow}\) 2KCl + 3O2
\(\overset{t^{\circ } }{\rightarrow}\) 2KCl + 3O2
2KMnO4 ![]() \(\overset{t^{\circ } }{\rightarrow}\) K2MnO4 + MnO2 + O2
\(\overset{t^{\circ } }{\rightarrow}\) K2MnO4 + MnO2 + O2
II. Bài tập vận dụng, mở rộng
1. Phần câu hỏi trắc nghiệm
Câu 1. Trong phòng thí nghiệm, khí oxi được điều chế bằng cách đun nóng hợp chất nào sau đây?
A. KMnO4
B. H2O
C. CaCO3
D. Na2CO3
Câu 2. Có thể thu oxi bằng phương pháp đẩy nước vì
A. Oxi nhẹ hơn nước
B. Oxi nặng hơn nước
C. Oxi ít tan trong nước
D. Oxi tan nhiều trong nước
Câu 3. Trong công nghiệp sản xuất khí oxi bằng cách
A. Chưng cất không khí
B. Lọc không khí
C. Hóa lỏng không khí, sau đó cho không khí lỏng bay hơi
D. Hóa lỏng không khí, sau đó chiết lấy oxi
Câu 4. Phản ứng nào sau đây là phản ứng phân hủy
A. 4P + 5O2 ![]() \(\overset{t^{\circ } }{\rightarrow}\)2P2O5
\(\overset{t^{\circ } }{\rightarrow}\)2P2O5
B. Fe(OH)3 ![]() \(\overset{t^{\circ } }{\rightarrow}\) Fe2O3 + 3H2O
\(\overset{t^{\circ } }{\rightarrow}\) Fe2O3 + 3H2O
C. CO + O2 ![]() \(\overset{t^{\circ } }{\rightarrow}\) CO2
\(\overset{t^{\circ } }{\rightarrow}\) CO2
D. 2Cu + O2 ![]() \(\overset{t^{\circ } }{\rightarrow}\) 2CuO
\(\overset{t^{\circ } }{\rightarrow}\) 2CuO
Câu 5. Khí Oxi không phản ứng được với chất nào dưới đây.
A. CO
B. Cl2
C. Fe
D. C2H4
Câu 6. Để điều chế 1 lượng khí oxi thì sử dụng hóa chất nào dưới đây để khối lượng dùng nhỏ nhất?
A. H2O
B. KMnO4
C. KNO3
D. KClO3
Câu 7. Muốn điều chế được 3,36 lít khí oxi (đktc) thì khối lượng KMnO4 cần nhiệt phân là:
A. 47,4 gam
B. 23,7 gam
C. 15,8 gam
D. 31,6 gam
Câu 8. Từ 25,25 gam KNO3 nhiệt phân hoàn toàn thì thu được bao nhiêu lít khí oxi (đktc)
A. 5,6 lít
B. 8,4 lít
C. 3,7 lít
D. 11,2 lít
Câu 9. Dãy hóa chất nào dưới đây dùng để điều chế oxi trong phòng thí nghiệm
A. Không khí, KMnO4
B. KMnO4, KClO3
C. NaNO3, KNO3
D. H2O, không khí
Câu 10. Trong phòng thí nghiệm, người ta điều chế oxi bằng cách nhiệt phân KClO3 hay KMnO4 hoặc KNO3. Vì lý do nào sau đây?
A. Dễ kiếm, rẻ tiền
B. Giàu oxi và dễ phân hủy ra oxi
C. Phù hợp với thiết bị hiện đại
D. Không độc hại
Câu 11: Phản ứng phân hủy là
A. Ba + 2HCl → BaCl2 + H2
B. Cu + H2S → CuS + H2
C. MgCO3 → MgO + CO2
D. KMnO4 → MnO + O2 + K2O
Câu 12: Cho phản ứng 2KMnO4 ![]() \(\overset{t^{\circ } }{\rightarrow}\) K2MnO4 + MnO2 + O2
\(\overset{t^{\circ } }{\rightarrow}\) K2MnO4 + MnO2 + O2
Tổng hệ số sản phẩm là
A. 3
B. 2
C. 1
D. 5
Câu 13: Tính khối lượng KMnO4 biết nhiệt phân thấy 2,7552 l khí bay lên
A. 38,678 g
B. 38,868 g
C. 37,689 g
D. 38,886 g
Câu 14: Phương trình không điều chế oxi trong phòng thí nghiệm
A. 2KMnO4 ![]() \(\overset{t^{\circ } }{\rightarrow}\) K2MnO4 + MnO2 + O2 ↑
\(\overset{t^{\circ } }{\rightarrow}\) K2MnO4 + MnO2 + O2 ↑
B. 2H2O2 ![]() \(\overset{t^{\circ } }{\rightarrow}\) 2H2O + O2
\(\overset{t^{\circ } }{\rightarrow}\) 2H2O + O2
C. 2KClO3 ![]() \(\overset{t^{\circ } }{\rightarrow}\) 2KCl + 3O2
\(\overset{t^{\circ } }{\rightarrow}\) 2KCl + 3O2
D. 2H2O ![]() \(\overset{t^{\circ } }{\rightarrow}\) 2H2 + O2
\(\overset{t^{\circ } }{\rightarrow}\) 2H2 + O2
Câu 15. Chọn nhận xét đúng
A. Phản ứng phân hủy là một dạng của phản ứng hóa học
B. Phản ứng hóa hợp là phản ứng oxi hóa khử
C. Phản ứng phân hủy là phản ứng sinh ra duy nhất 2 chất mới
D. Cả A và C đều đúng
2. Hướng dẫn giải bài tập
| 1 A | 2 C | 3 C | 4 B | 5 B |
| 6 A | 7 A | 8 B | 9 B | 10 B |
| 11 C | 12 A | 13 B | 14 D | 15 A |
Câu 7
Tính số mol của oxi:
![]() \({n_{{O_2}}} = \frac{V}{{22,4}} = \frac{{3,36}}{{22,4}} = 0,15(mol)\)
\({n_{{O_2}}} = \frac{V}{{22,4}} = \frac{{3,36}}{{22,4}} = 0,15(mol)\)
Xét phản ứng: 2KMnO4 ![]() \(\overset{t^{\circ } }{\rightarrow}\) K2MnO4 + MnO2 + O2
\(\overset{t^{\circ } }{\rightarrow}\) K2MnO4 + MnO2 + O2
Theo PTHH: 2mol 1mol
Theo đề bài: ![]() \(\frac{{0,15.2}}{1} = 0,3(mol)\) ← 0,15
\(\frac{{0,15.2}}{1} = 0,3(mol)\) ← 0,15
Từ phương trình hóa học ta có: nKMnO4 = 0,4 mol
Khối lượng của KMnO4 cần cho phản ứng phân hủy bằng: 0,3.158 = 47,4 gam
Câu 8.
![]() \({n_{KCl{O_3}}} = \frac{{25,25}}{{101}} = 0,25(mol)\)
\({n_{KCl{O_3}}} = \frac{{25,25}}{{101}} = 0,25(mol)\)
Xét phản ứng: 2KClO3 ![]() \(\overset{t^{\circ } }{\rightarrow}\) 2KCl + 3O2
\(\overset{t^{\circ } }{\rightarrow}\) 2KCl + 3O2
Theo PTHH: 2mol 3mol
Theo đề bài: 0,25 mol ![]() \(\frac{{0,25.3}}{2} = 0,375(mol)\)
\(\frac{{0,25.3}}{2} = 0,375(mol)\)
Từ phương trình hóa học ta có: nO2 = 0,375 mol
Thể tích khí O2 thu được sau phản ứng bằng: VO2 = 0,375.22,4 = 8,4 lít
3. Câu hỏi luyện tập tự luận
Câu 1. Đốt cháy hoàn toàn m gam Photpho trong không khí thu được hợp chất điphotpho pentaoxit P2O5. Tính khối lượng của photpho cần dùng để phản ứng đủ với 3,36 lít khí O2 (đktc)
Câu 2. Đốt cháy sắt thu được 0,3 mol Fe3O4. Tính thể tích khí oxi (đktc) đã dùng.
Câu 3. Đốt cháy hoàn toàn 23,3 gam hỗn hơp 2 kim loại Mg và Zn trong bình kín đựng khí oxi, sau phản ứng xảy ra hoàn toàn thu được 36,1 gam hỗn hợp 2 oxit.
a) Viết phương trình hóa học xảy ra.
b) Tính thể tích khí oxi (đktc) đã dùng để đốt cháy lượng kim loại trên
c) Tính khối lượng mỗi kim loại trong hỗn hợp trên.
Câu 4. Đốt cháy 13 gam một kim loại hóa trị II trong oix dư, thu được 16,2 gam chất rắn. Xác định kim loại đó.
Câu 5. Đốt cháy hoàn toàn 1 hợp chất hữu cơ X có công thức tổng quát CxHy (x, y nguyên dương) trong bình oxi, thu được 6,72 lít khí CO2 (đktc) và 7,2 gam H2O. Xác định công thức hóa học của chất hữu cơ X. Biết khối lượng mol của chất hữu cơ X là 44 (gam/mol)
IV. Giải bài tập Hóa 8 bài 27
Để giúp các bạn học sinh học tập tốt hơn cũng như biết cách giải các dạng bài tập sách giáo khoa Hóa 8 VnDoc hướng dẫn giải chi tiết các bài tập sách giáo khoa Hóa 8 bài 27 tại: Giải Hóa 8 bài 27: Điều chế khí oxi – Phản ứng phân hủy
V. Giải bài tập trắc nghiệm hóa 27
Ngoài các dạng bài tập sách giáo khoa Hóa 8 bài 27, để nâng cao cũng như rèn luyện thêm khả năng làm bài tập, các bạn học sinh cần bổ sung thêm các dạng bài tập câu hỏi sách bài tập Hóa 8, VnDoc biên soạn kèm hướng dẫn giải tại: Giải bài tập SBT Hóa học lớp 8 bài 27: Điều chế oxi - Phản ứng phân hủy
...........................
Mời các bạn tham khảo thêm một số tài liệu liên quan:
- Giải bài tập SBT Hóa học lớp 8 bài 28: Không khí - Sự cháy
- Trắc nghiệm Hóa học 8 bài 27
- Giải bài tập trang 94 SGK Hóa lớp 8: Điều chế khí oxi – Phản ứng phân hủy
Để có kết quả cao hơn trong học tập, VnDoc xin giới thiệu tới các bạn học sinh tài liệu Chuyên đề Toán 8, Chuyên đề Vật Lý 8, Chuyên đề Hóa 8, Tài liệu học tập lớp 8 mà VnDoc tổng hợp và đăng tải.
Ngoài ra, VnDoc.com đã thành lập group chia sẻ tài liệu học tập THCS miễn phí trên Facebook: Tài liệu học tập lớp 8. Mời các bạn học sinh tham gia nhóm, để có thể nhận được những tài liệu mới nhất.








