Giải SBT Hóa 8 bài 27: Điều chế oxi - Phản ứng phân hủy
Giải bài tập SBT Hóa học lớp 8 bài 27
- Bài 27.1 trang 37 sách bài tập Hóa 8
- Bài 27.2 trang 37 sách bài tập Hóa 8
- Bài 27.3 trang 38 sách bài tập Hóa 8
- Bài 27.4 trang 38 sách bài tập Hóa 8
- Bài 27.5 trang 38 sách bài tập Hóa 8
- Bài 27.6* trang 38 sách bài tập Hóa 8
- Bài 27.7 trang 38 sách bài tập Hóa 8
- Bài 27.8 trang 38 sách bài tập Hóa 8
- Bài 27.9 trang 39 sách bài tập Hóa 8
Giải SBT Hóa 8 bài 27: Điều chế oxi - Phản ứng phân hủy tổng hợp lời giải chi tiết, rõ ràng các câu hỏi trong vở bài tập Hóa học lớp 8, các bài giải tương ứng với từng bài học trong sách giúp cho các em học sinh ôn tập và củng cố các dạng bài tập, rèn luyện kỹ năng giải môn Hóa lớp 8. Chúc các em học tốt.
Bài 27.1 trang 37 sách bài tập Hóa 8
Cho các phản ứng sau:
(1) 2NaNO3 ![]() \(\overset{t^{\circ } }{\rightarrow}\) 2NaNO2 + O2↑
\(\overset{t^{\circ } }{\rightarrow}\) 2NaNO2 + O2↑
(2) 2H2O ![]() \(\overset{điện phân }{\rightarrow}\)2H2 + O2↑
\(\overset{điện phân }{\rightarrow}\)2H2 + O2↑
(3) CaO + CO2 → CaCO3
(4) ZnS + 3O2 ![]() \(\overset{t^{\circ } }{\rightarrow}\) 2 ZnO + 2SO2↑
\(\overset{t^{\circ } }{\rightarrow}\) 2 ZnO + 2SO2↑
(5) K2O + H2O → 2KOH
(6) 2HNO3 ![]() \(\overset{t^{\circ } }{\rightarrow}\) 2NO2 + H2O +1/2O2↑
\(\overset{t^{\circ } }{\rightarrow}\) 2NO2 + H2O +1/2O2↑
Số phản ứng thuộc loại phản ứng phân hủy là:
A. 2
B. 3
C. 4
D. 5
Đáp án hướng dẫn giải
Chọn B.
Bài 27.2 trang 37 sách bài tập Hóa 8
Trong bài thực hành thu khí oxi vào ống nghiệm bằng cách đẩy nước và đẩy không khí. Có 4 học sinh A, B, C, D đã lắp ráp dụng cụ thí nghiệm như sau đây. Hãy cho biết học sinh nào lắp ráp đúng? Giải thích. Xác định công thức các chất 1, 2, 3 có trong hình vẽ của thí nghiệm.
Đáp án hướng dẫn giải
Học sinh A, C rap đúng
Học sinh B, D ráp thí nghiệm sai vì ống dẫn khí oxi không đi vào ống nghiêm làm cho khí oxi sẽ mất mát 1 ít.


Bài 27.3 trang 38 sách bài tập Hóa 8
Điều chế oxi trong công nghiệp bằng phương pháp điện phân nước (có axit sunfuric), thu được 2 chất khí riêng biệt là oxi và hidro. Phương trình điện phân nước được biểu diễn như sau:
2H2O ![]() \(\overset{đp}{\rightarrow}\) 2H2 + O2
\(\overset{đp}{\rightarrow}\) 2H2 + O2
(lỏng) (khí) (khí)
Điền những số liệu thích hợp vào chỗ trống trong bảng dưới đây:
|
H2O đã dùng |
H2 tạo thành |
O2 tạo thành |
|
a) 2mol |
……mol |
……mol |
|
b) ……mol |
……..g |
16g |
|
c)…….mol |
10g |
……g |
|
d) 45g |
……….g |
……g |
|
e) ……g |
8,96lit(đktc) |
…….lit(đktc) |
|
f) 66,6g |
………g |
………lit(đktc) |
(Giả sử phản ứng điện phân nước xảy ra hoàn toàn).
Đáp án hướng dẫn giải
|
H2O đã dùng |
H2 tạo thành |
O2 tạo thành |
|
a) 2 mol |
2 mol |
1 mol |
|
b) 1 mol |
2 g |
16g |
|
c)5 mol |
10g |
80 g |
|
d) 45 g |
5 g |
40 g |
|
e) 7,2 g |
8,96lit(đktc) |
4,48 lit(đktc) |
|
f) 66,6g |
74 g |
41,44 lit(đktc) |
Bài 27.4 trang 38 sách bài tập Hóa 8
a) Trong những chất sau, những chất nào được dùng để điều chế khí oxi? Viết phương trình phản ứng và nêu điều kiện phản ứng:
CuSO4; KClO3; CaCO3; KMnO4; H2O; K2SO4; HgO
b) Tất cả các phản ứng điều chế O2 có thể gọi là phản ứng phân hủy không?Hãy giải thích.
Đáp án hướng dẫn giải
a) Các chất được dùng để điều chế oxi:
a) Những chất được dùng để điều chế oxi:
2KClO3 ![]() \(\overset{t^{\circ } }{\rightarrow}\) 2KCl + 3O2↑
\(\overset{t^{\circ } }{\rightarrow}\) 2KCl + 3O2↑
2KMnO4 ![]() \(\overset{t^{\circ } }{\rightarrow}\) K2MnO4 + O2↑ + MnO2
\(\overset{t^{\circ } }{\rightarrow}\) K2MnO4 + O2↑ + MnO2
2HgO ![]() \(\overset{t^{\circ } }{\rightarrow}\) 2Hg + O2↑
\(\overset{t^{\circ } }{\rightarrow}\) 2Hg + O2↑
2H2O ![]() \(\overset{đp }{\rightarrow}\) 2H2↑ + O2↑
\(\overset{đp }{\rightarrow}\) 2H2↑ + O2↑
b) Tất cả phản ứng điều chế O2 đều là phản ứng phân hủy vì từ 1 chất sau phản ứng tạo ra nhiều chất mới.
Bài 27.5 trang 38 sách bài tập Hóa 8
Để điều chế một lượng lớn oxi trong công nghiệp người ta dùng những phương pháp nào và bằng những nguyên liệu gì?
Đáp án hướng dẫn giải
Trong công nghiệp người ta điều chế oxi thường dùng phương pháp: điện phân H2O hoặc hóa lỏng không khí (ở -196oC) rồi cho bay hơi trở lại, nito thoát ra trước rồi đến oxi.
Nguồn nguyên liệu phong phú và rẻ nhất đó là H2O và không khí.
Bài 27.6* trang 38 sách bài tập Hóa 8
Lấy cùng một lượng KClO3 và KMnO4 để điều chế oxi. Chất nào tạo ra nhiều khí O2 hơn.
a) Viết phương trình phản ứng và giải thích.
b) Nếu điều chế dùng một thể tích khí oxi thì dùng chất nào kinh tế hơn? Biết rằng giá KMnO4 là 30.000 đ/kg và KClO3 là 96.000 đ/kg.
Đáp án hướng dẫn giải
a) Giả sử ta lấy cùng một khối lượng.
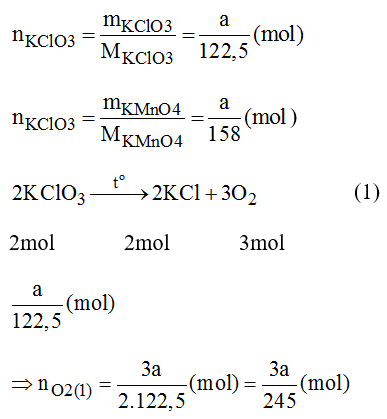

Vậy nO2(2) > nO2(1) nên khi nhiệt phân cùng 1 lượng chất cho nhiều oxi hơn là KClO3

Số tiền mua 122,5g để điều chế 1,5mol O2:
0,1225.96000 = 11760(đồng)

Số tiền mua 474g để điều chế 1,5 mol O2:
0,474.30000 = 14220(đồng)
Vậy để điều chế cùng 1 thể tích khí O2 thì dùng KClO3 để điều chế tinh tế hơn tuy giá tiền cao hơn nhưng thể tích khí O2 sinh ra nhiều hơn.
Bài 27.7 trang 38 sách bài tập Hóa 8
Dùng 3,2 kg khí oxi để đốt cháy khí axetilen. Hỏi với lượng khí oxi như trên, có thể đốt cháy bao nhiêu m3 khí axetilen (đktc).
Đáp án hướng dẫn giải

Thể tích khí axetilen bị đốt cháy là 896l = 0,896m3.
Bài 27.8 trang 38 sách bài tập Hóa 8
Đốt cháy hoàn toàn 5,4g Al.
a) Tính thể tích oxi cần dùng.
b) Tính số gam KMnO4 cần dùng để điều chế lượng oxi trên.
Lời giải:

Vậy để điều chế 0,15 mol oxi thì cần 47,4g KMnO4.
Bài 27.9 trang 39 sách bài tập Hóa 8
Người ta điều chế vôi sống (CaO) bằng cách nung đá voi CaCO3. Lượng vôi sống thu được từ 1 tấn đá vôi có chứa 10% tạp chất là:
A.0,252 tấn. B. 0,378 tấn. C. 0,504 tấn D. 0,606 tấn.
(Biêt hiệu suất phản ứng là 100%).
Đáp án hướng dẫn giải
Khối lượng CaCO3 nguyên chất:

→ Chọn C.
................................................
Mời các bạn tham khảo thêm một số tài liệu:
- Giải bài tập SBT Hóa học lớp 8 bài 32: Phản ứng oxi hóa - khử
- Giải bài tập SBT Hóa học lớp 8 bài 33: Điều chế khí Hidro - Phản ứng thế
Để có kết quả cao hơn trong học tập, VnDoc xin giới thiệu tới các bạn học sinh tài liệu Chuyên đề Toán 8, Chuyên đề Vật Lý 8, Chuyên đề Hóa 8, Tài liệu học tập lớp 8 mà VnDoc tổng hợp và đăng tải.
Ngoài ra, VnDoc.com đã thành lập group chia sẻ tài liệu học tập THCS miễn phí trên Facebook: Tài liệu học tập lớp 8. Mời các bạn học sinh tham gia nhóm, để có thể nhận được những tài liệu mới nhất.







