Giải SBT Hóa 8 bài 15: Định luật bảo toàn khối lượng
Giải bài tập SBT Hóa học lớp 8 bài 15
Giải SBT Hóa 8 bài 15: Định luật bảo toàn khối lượng tổng hợp lời giải chi tiết, rõ ràng các câu hỏi trong vở bài tập Hóa học lớp 8, các bài giải tương ứng với từng bài học trong sách giúp cho các em học sinh ôn tập và củng cố các dạng bài tập, rèn luyện kỹ năng giải môn Hóa lớp 8. Chúc các em học tốt.
A. Tóm tắt lý thuyết hóa 8 bài 15: Định luật bảo toàn khối lượng
Định luật bảo toàn khối lượng
Định luật bảo toàn khối lượng: Trong một phản ứng hóa học, tổng khối lượng của các chất sản phẩm bằng tổng khối lượng các chất tham gia phản ứng.
Ví dụ:
A + B → C + D
ĐLBTKL: mA + mB = mC + mD
Ứng dụng: Tính khối lượng các chất tham gia phản ứng hay tạo thành sau phản ứng.
Lưu ý:
Cần xác định chính xác khối lượng các chất tham gia phản ứng và sản phẩm
Dạng bài tập này có thể kết hợp với dạng bài tập viết phương trình hóa học của phản ứng.
B. Giải SBT Hóa 8 bài 15: Định luật bảo toàn khối lượng
Bài 15.1 trang 20 SBT Hóa 8
a) Viết công thức về khối lượng cho phản ứng giữa kim loại kẽm và axit HCl tạo ra chất kẽm clorua ZnCl2 và khí hidro. (xem lại hình 2.6, trong SGK về phản ứng này).
b) Cho biết khối lượng của kẽm và axit clohidric đã phản ứng là 6,5g và 7,3g, khối lượng của chất kẽm clorua là 13,6g.
Hãy tính khối lượng của khí hidro bay lên.
Đáp án hướng dẫn giải chi tiết
a) Áp dung định luật bảo toàn khối lượng
mZn + mHCl = mZnCl2 + mH2
b) Áp dung định luật bảo toàn khối lượng
mH2 = (mZn + mHCl) - mZnCl2
= (6,5 + 7,3) – 13,6 = 0,2(g)
Bài 15.2 trang 20 SBT Hóa 8
Biết rằng axit clohidric có phản ứng với chất canxi cacbonat tạo ra chất canxi clorua, nước và khí cacbon đioxit thoát ra. Một cốc đựng dung dịch axit clohidric (1) và cục đá (2) (thành phần chính là chất canxi cacbonat) được đặt trên một đĩa cân. Trên đĩa cân thứ hai đặt quả cân (3) vừa đủ cho cân ở vị trí cân bằng.
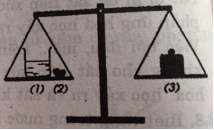
Bỏ cục đá vôi vào dung dịch axit clohidric. Sau một thời gian phản ứng, cân ở vị trí nào: A, B hay C? Giải thích.
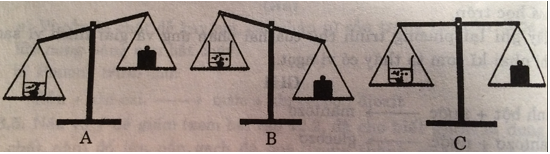
Đáp án hướng dẫn giải chi tiết
Chọn B. Vì trong phản ứng có một lượng khí cacbon đioxit thoát ra ngoài nên khối lượng sẽ giảm đi.
Bài 15.3 trang 20 SBT Hóa 8
Hãy giải thích vì sao?
a) Khi nung nóng cục đá vôi thì thấy khối lượng giảm đi? (Xem lại bài tập 12.3 về đá vôi trong lò nung vôi)
b) Khi nung nóng miếng đồng trong không khí (có khí oxi) thì thấy khối lượng tăng lên? (Xem bài tập 3, thuộc Bài 15, SGK; khi đun nóng kim loại đồng (Cu) cũng có phản ứng tương tự kim loại magie (Mg).
Đáp án hướng dẫn giải chi tiết
a) Khi nung đá vôi thì có khí cacbon đioxit thoát ra nên khối lượng giảm đi.
b) Vì khi đun nóng miếng đồng trong không khí thì đồng hóa hợp với oxi tạo ra chất mới nên khối lượng tăng.
Bài 15.4 trang 20 SBT Hóa 8
Đun nóng mạnh hỗn hợp gồm 28g bột sắt và 20g bột lưu huỳnh thu được 44g chất sắt (II) sunfua (FeS) màu xám.
Biết rằng, để cho phản ứng hóa hợp xảy ra hết người ta đã lấy dư lưu huỳnh. Tính khối lượng lưu huỳnh lấy dư.
Đáp án hướng dẫn giải chi tiết
Theo định luật bảo toàn khối lượng, ta có công thức khối lượng của phản ứng:
mFe + mS = mFeS
Khối lượng lưu huỳnh đã hóa hợp với sắt là:
mS = mFeS – mFe = 44 – 28 = 16 (g)
Khối lượng lưu huỳnh lấy dư: 20 – 16 = 4 (g)
Bài 15.5* trang 21 SBT Hóa 8
Biết rằng canxi oxit (vôi sống) CaO hóa hợp với nước tạo ra canxi hidroxit (vôi tôi) Ca(OH)2, chất này tan được trong nước, cứ 56g CaO hóa hợp vừa đủ với 18g H2O. Bỏ 2,8g CaO vào trong một cốc lớn chứa 400ml nước tạo ra dung dịch Ca(OH)2, còn gọi là nước vôi trong.
a) Tính khối lượng của canxi hidroxit.
b) Tính khối lượng của dung dịch Ca(OH)2, giả sử nước trong cốc là nước tinh khiết.
Đáp án hướng dẫn giải chi tiết
a) Ta có:
Cứ 56g CaO hóa hợp vừa đủ với 18g H2O.
Vậy 2,8g CaO hóa hợp vừa đủ với x(g) H2O.
→ x = (2,8 x 18)/56 = 0,9 (g)
Công thức khối lượng của phản ứng:
mCaO + mH2O = mCa(OH)2
2,8 + 0,9 = 3,7 (g)
Vậy khối lượng của Ca(OH)2 là 3,7g.
b) Vì nước tinh khiết có D = 1g/ml → mH2O = 400g.
Vậy khối lượng của dd Ca(OH)2: 2,8 + 400 = 402,8g.
Bài 15.6* trang 21 SBT Hóa 8
Đung nóng 15,8g kali pemanganat (thuốc tím) KMnO4 trong ống nghiệm để điều chế khí oxi. Biết rằng, chất rắn còn lại trong ống nghiệm có khối lượng 12,6g; khối lượng khí oxi thu được là 2,8g. Tính hiệu suất của phản ứng phân hủy.
Đáp án hướng dẫn giải chi tiết
Theo định luật bảo toàn khối lượng ta có: mO2 = 15,8 – 12,6 = 3,2 (g)
Hiệu suất của phản ứng phân hủy: H = 2,8/3,2 x 100 = 87,5%
Bài 15.7* trang 21 SBT Hóa 8
Còn có thể điều chế khí oxi bằng cách nung nóng kali clorat KClO3 (chất rắn màu trắng). Khi đun nóng 24,5g KClO3, chất rắn còn lại trong ống nghiệm có khối lượng là 13,45g. Tính khối lượng khí oxi thu được, biết hiệu suất của phản ứng phân hủy là 80%.
Đáp án hướng dẫn giải chi tiết
Theo định luật bảo toàn khối lượng, ta có khối lượng khí oxi thu được là:
mO2 = 24,5 – 13,45 = 11,05 (g)
Khối lượng thực tế oxi thu được: mO2 = (11,05 x 80)/100 = 8,84 (g)
>> Mời các bạn tham giải hóa 8 sách bài tập bài tiếp theo tại: Giải SBT Hóa 8 bài 16: Phương trình hóa học
C. Giải Hóa 8 bài 15: Định luật bảo toàn khối lượng
Để giúp các bạn hoàn thành tốt các dạng bài tập trong sách giáo khoa Hóa 8 bài 15. Cũng như củng cố ghi nhớ kiến thức bài học từ đó vận dụng tốt vào giải các dạng câu hỏi bài tập và học tốt môn Hóa học 8. VnDoc đã hướng dẫn giải chi tiết bài tập Sách giáo khoa Hóa 8 bài 15 tại: Giải Hóa 8 bài 15 Định luật bảo toàn khối lượng.
D. Trắc nghiệm hóa 8 bài 15: Định luật bảo toàn khối lượng
Để củng cố kiến thức nội dung bài học trên lớp, cũng như rèn luyện bổ sung kiến thức bài học. VnDoc đã biên soạn tổng hợp bộ câu hỏi trắc nghiệm hóa 8 bài 15 gồm 15 câu hỏi trắc nghiệm khách quan kèm đáp án hướng dẫn giải chi tiết tại: Trắc nghiệm hóa 8 bài 15: Định luật bảo toàn khối lượng
............................................
VnDoc giới thiệu tới các bạn Giải SBT Hóa 8 bài 15: Định luật bảo toàn khối lượng được VnDoc biên soạn. Với tới liệu này sẽ giúp hướng dẫn các bạn học sinh nắm chắc định luật, vận dụng một cách linh hoạt vào giải các dạng bài tập sách bài tập hóa 8.
Mời các bạn tham khảo một số tài liệu liên quan:
- Hóa học 8 Bài 16: Phương trình hóa học
- Giáo án Hóa học 8 bài 15: Định luật bảo toàn khối lượng
- Giải bài tập trang 57, 58 SGK Hóa lớp 8: Phương trình hóa học
Để có kết quả cao hơn trong học tập, VnDoc xin giới thiệu tới các bạn học sinh tài liệu Chuyên đề Toán 8, Chuyên đề Vật Lý 8, Chuyên đề Hóa 8, Tài liệu học tập lớp 8 mà VnDoc tổng hợp và đăng tải.
Ngoài ra, VnDoc.com đã thành lập group chia sẻ tài liệu học tập THCS miễn phí trên Facebook: Tài liệu học tập lớp 8. Mời các bạn học sinh tham gia nhóm, để có thể nhận được những tài liệu mới nhất.







