Giải SBT Hóa 8 bài 21: Tính theo công thức hóa học
Giải bài tập SBT Hóa học lớp 8 bài 21: Tính theo công thức hóa học tổng hợp lời giải chi tiết, rõ ràng các câu hỏi trong vở bài tập Hóa học lớp 8, các bài giải tương ứng với từng bài học trong sách giúp cho các em học sinh ôn tập và củng cố các dạng bài tập, rèn luyện kỹ năng giải môn Hóa lớp 8. Chúc các em học tốt.
Giải bài tập SBT Hóa học lớp 8 bài 21
A. Giải SBT Hóa 8 bài 21
Bài 21.1 trang 28 sách bài tập Hóa 8
Đốt cháy hoàn toàn 0,24g magie (Mg) trong không khí, người ta thu được 0,4g magie oxit. Em hãy tìm công thức hóa học đơn giản của magie oxit.
Lời giải:
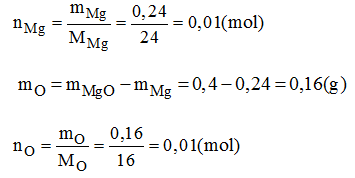
Vậy trong 1 phân tử hợp chất có 0,01 mol nguyên tử Mg; 0,01 mol nguyên tử O. Có nghĩa là 1 mol nguyên tử Mg kết hợp với 1 mol nguyên tử O.
→ Công thức hóa học đơn giản của magie oxit là: MgO.
Bài 21.2 trang 28 sách bài tập Hóa 8
Biết 4g thủy ngân (Hg) kết hợp với clo tạo ra 5,42g thủy ngân clorua. Em hãy cho biết công thức hóa học đơn giản của thủy ngân clorua. Cho biết Hg = 200.
Lời giải:
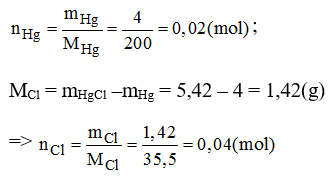
Vậy 0,02 mol nguyên tử Hg kết hợp với 0,04 mol nguyên tử Cl.
Suy ra 1 mol nguyên tử Hg kết hợp với 2 mol nguyên tử Cl.
→ Công thức của thủy ngân clorua: HgCl2.
Bài 21.3 trang 28 sách bài tập Hóa 8
Một loại oxi sắt có thành phần là: 7 phần khối lượng sắt kết hợp với 3 phần khối lượng oxi. Em hãy cho biết:
a) Công thức phân tử của oxit sắt, biết công thức phân tử cũng chính là công thức đơn giản.
b) Khối lượng mol của oxit sắt tìm được ở trên.
Hướng dẫn gaiir bài tập
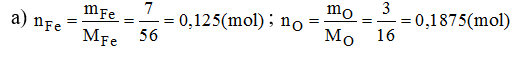
Vậy: 0,125 mol nguyên tử Fe kết hợp với 0,1875 mol nguyên tử O.
Suy ra 2 mol nguyên tử Fe kết hợp với 3 mol nguyên tử O (vì số nguyên tử luôn là số nguyên).
→ Công thức hóa học đơn giản của oxit sắt là: Fe2O3.
b) Khối lượng mol của Fe2O3: (56.2) + (16.3) = 160 (g).
Bài 21.4 trang 28 sách bài tập Hóa 8:
Một hợp chất khí có thành phần phần trăm theo khối lượng là 82,35% N và 17,65% H. Em hãy cho biết:
a) Công thức hóa học của hợp chất. Biết hợp chất này có tỉ khối đối với khí hidro là 8,5.
b) Số mol nguyên tử của nguyên tố có trong 0,5 mol hợp chất.
Lời giải:
![]()
Khối lượng của nito trong 1 mol hợp chất:
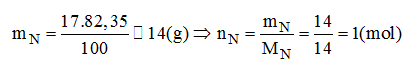
Khối lượng của hidro trong 1 mol hợp chất:
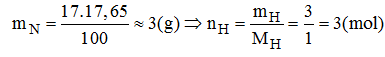
Vậy trong hợp chất có 1 mol nguyên tử N và 3 mol nguyên tử H.
→ Công thức hóa học đơn giản của hợp chất là NH3.
b) Trong 0,5 mol NH3 có: 0,5 mol nguyên tử N
0,5 x 3 = 1,5 mol nguyên tử H.
Bài 21.5 trang 28 sách bài tập Hóa 8
Phân đạm ure có công thức hóa học là CO(NH2)2. Hãy xác định:
a) Khối lượng mol phân tử của ure.
b) Thành phần phần trăm (theo khối lượng) các nguyên tố trong phân đạm ure.
c) Trong 2 mol phân tử ure có bao nhiêu mol nguyên tử của mỗi nguyên tố.
Hướng dẫn giải bài tập
![]()
b) Thành phần % các nguyên tố trong ure:
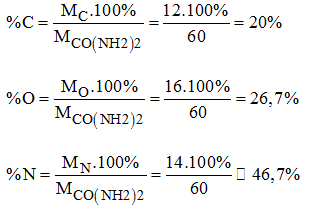
%H = 100-(%C + %O + %N) = 100- ( 20 + 26,7 + 46,7) = 6,6%
c) Trong 2 mol phân tử CO(NH2)2 có:
Nguyên tố C: 2x1 = 2 mol nguyên tử C.
Nguyên tố O: 2x1 = 2 mol nguyên tử O.
Nguyên tố N: 2x2 = 4 mol nguyên tử N.
Nguyên tố H: 2x4 = 8 mol nguyên tử H.
Bài 21.6 trang 28 sách bài tập Hóa 8
Có những chất sau: 32g Fe2O3; 0,125g mol PbO; 28g CuO.
Hãy cho biết:
a) Khối lượng của mỗi kim loại co trong những lượng chất đã cho.
b) Thành phần phần trăm (Theo khối lượng) mỗi nguyên tố có trong mỗi hợp chất trên.
Hướng dẫn giải bài tập
a) nFe2O3 = mFe2O3/MFe2O3 = 32/160 = 0,2 mol
Cứ 1 mol Fe2O3 có 2 mol Fe
Vậy 0,2 mol Fe2O3 có x? mol Fe
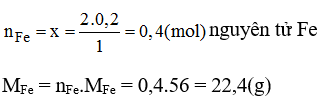
- Trong 0,125 mol phân tử PbO có 0,125 mol nguyên tử Pb.
Khối lượng của Pb = mPb = nPb.MPb = 0,125.207 = 25,875(g)
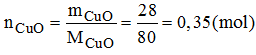
Trong 0,35 mol phân tử CuO có 0,35 mol nguyên tử Cu.
Khối lượng của nguyên tử Cu: MCu = nCu.MCu = 0,35.6 = 22,4(g)
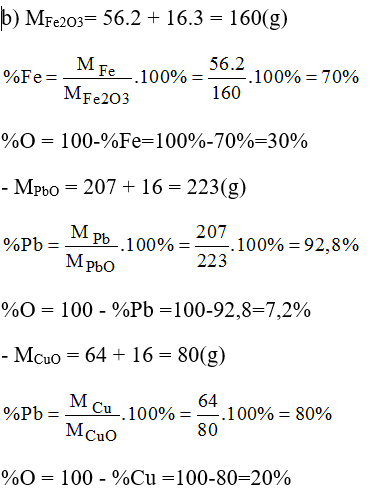
Bài 21.7 trang 28 sách bài tập Hóa 8
Đốt nóng hỗn hợp bột magie và lưu huỳnh, thu được hợp chất là magie sunfua. Biết 2 nguyên tố kết hợp với nhau theo tỉ lệ khối lượng là 3 phần magie với 4 phần lưu huỳnh.
a) Tìm công thức hóa học đơn giản của magie sunfua.
b) Trộn 8g magie vơi 8g lưu huỳnh rồi đốt nóng. Hãy cho biết thành phần và khối lượng các chất sau phản ứng.
A. 7g magie sunfua.
B. 7g magie sunfua và 8g lưu huỳnh.
C. 16g magie sunfua.
D. 14g Magie sunfua và 2g magie.
Hướng dẫn giải bài tập
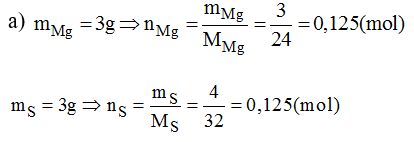
Vậy trong hợp chất: 0,125 mol nguyên tử Mg và 0,125 mol nguyên tử S. Có nghĩa là 1 mol nguyên tử Mg kết hợp với 1 mol nguyên tử S.
Nên công thức hóa học đơn giản của magie sunfua: MgS.
b) Chọn D. Vì:
Theo đề bài: 3g Mg kết hợp vừa đủ với 4g S.
Hoặc 6g Mg kết hợp vừa đủ với 8g S.
Nếu trộn 8g Mg với 8g S thì sẽ sinh ra 14g MgS và còn dư 2g Mg.
B. Giải Hóa 8 bài 21
Để giúp các bạn học sinh học tập tốt hơn cũng như hoàn thành tốt hơn các bài tập SBT, VnDoc đã biên soạn hướng dẫn giải chi tiết bài tập hóa 8 tại: Giải Hóa 8 Bài 21: Tính theo công thức hóa học
.............................................
Mời các bạn tham khảo một số tài liệu liên quan:
- Giải bài tập trang 75, 76 SGK Hóa lớp 8: Tính theo phương trình hóa học
- Trắc nghiệm Hóa học 8 bài 22
Để có kết quả cao hơn trong học tập, VnDoc xin giới thiệu tới các bạn học sinh tài liệu Chuyên đề Toán 8, Chuyên đề Vật Lý 8, Chuyên đề Hóa 8, Tài liệu học tập lớp 8 mà VnDoc tổng hợp và đăng tải.
Ngoài ra, VnDoc.com đã thành lập group chia sẻ tài liệu học tập THCS miễn phí trên Facebook: Tài liệu học tập lớp 8. Mời các bạn học sinh tham gia nhóm, để có thể nhận được những tài liệu mới nhất.







