Giải SBT Hóa 8 bài 24: Tính chất của Oxi
Giải bài tập SBT Hóa học lớp 8 bài 24: Tính chất của Oxi tổng hợp lời giải chi tiết, rõ ràng các câu hỏi trong vở bài tập Hóa học lớp 8, các bài giải tương ứng với từng bài học trong sách giúp cho các em học sinh ôn tập và củng cố các dạng bài tập, rèn luyện kỹ năng giải môn Hóa lớp 8. Chúc các em học tốt.
Giải bài tập SBT Hóa học lớp 8 bài 24
- Bài 24.1 trang 32 sách bài tập Hóa 8
- Bài 24.2 trang 32 sách bài tập Hóa 8
- Bài 24.3 trang 32 sách bài tập Hóa 8
- Bài 24.4 trang 32 sách bài tập Hóa 8
- Bài 24.5 trang 33 sách bài tập Hóa 8
- Bài 24.6 trang 33 sách bài tập Hóa 8
- Bài 24.7 trang 33 sách bài tập Hóa 8
- Bài 24.8 trang 33 sách bài tập Hóa 8
- Bài 24.9 trang 33 sách bài tập Hóa 8
- Bài 24.10 trang 33 sách bài tập Hóa 8
- Bài 24.11 trang 34 sách bài tập Hóa 8
- Bài 24.12 trang 34 sách bài tập Hóa 8
- Bài 24.13 trang 34 sách bài tập Hóa 8
- Bài 24.14 trang 34 sách bài tập Hóa 8
- Bài 24.15 trang 34 sách bài tập Hóa 8
- Bài 24.16 trang 34 sách bài tập Hóa 8
- Bài 24.17 trang 34 sách bài tập Hóa 8
- Bài 24.18 trang 34 sách bài tập Hóa 8
- Bài 24.19 trang 34 sách bài tập Hóa 8
Bài 24.1 trang 32 sách bài tập Hóa 8
Phát biểu nào sau đây đúng?
A. Oxi là chất khí tan ít trong nước và nhẹ hơn không khí.
B. Oxi là chất khí tan vô hạn trong nước và nặng hơn không khí.
C. Khí oxi dễ dàng tác dụng được với nhiều đơn chất (kim loại, phi kim) và hợp chất.
D. Ở nhiệt độ cao, khí oxi dễ dàng tác dụng được với nhiều đơn chất (kim loại, phi kim) và hợp chất.
Hướng dẫn giải bài tập
Chọn D.
Bài 24.2 trang 32 sách bài tập Hóa 8
Viết phương trình hóa học của phản ứng giữa O2 với:
a) 3 kim loại hóa trị I, II, III.
b) 3 phi kim, thí dụ như C, S, P,…
c) 3 hợp chất, thí dụ như:
• Khí ga (butan C4H10) sinh ra khí cacbonic và nước.
• Khí ammoniac (NH3) sinh ra khí nito và nước.
• Khí hidro sunfua (H2S) sinh ra khí sunfuaro và nước.
Hướng dẫn giải bài tập
Phương trình hóa học của phản ứng giữa O2 với:
a) Ba kim loại:
4K + O2 ![]() \(\overset{t^{\circ } }{\rightarrow}\) 2K2O
\(\overset{t^{\circ } }{\rightarrow}\) 2K2O
2Ca + O2 ![]() \(\overset{t^{\circ } }{\rightarrow}\) 2CaO
\(\overset{t^{\circ } }{\rightarrow}\) 2CaO
4Al + 3O2 ![]() \(\overset{t^{\circ } }{\rightarrow}\) 2Al2O3
\(\overset{t^{\circ } }{\rightarrow}\) 2Al2O3
b) Ba phi kim:
C + O2 ![]() \(\overset{t^{\circ } }{\rightarrow}\) CO
\(\overset{t^{\circ } }{\rightarrow}\) CO
S + O2 ![]() \(\overset{t^{\circ } }{\rightarrow}\) SO2
\(\overset{t^{\circ } }{\rightarrow}\) SO2
4P + 5O2 ![]() \(\overset{t^{\circ } }{\rightarrow}\) 2P2O5
\(\overset{t^{\circ } }{\rightarrow}\) 2P2O5
c) Ba hợp chất:
C4H10 + 13/2O2 ![]() \(\overset{t^{\circ } }{\rightarrow}\) 4CO2 + 5H2O
\(\overset{t^{\circ } }{\rightarrow}\) 4CO2 + 5H2O
2NH3 + 3/2O2 ![]() \(\overset{t^{\circ } }{\rightarrow}\) N2 + 3H2O
\(\overset{t^{\circ } }{\rightarrow}\) N2 + 3H2O
H2S + 3/2O2 ![]() \(\overset{t^{\circ } }{\rightarrow}\) SO2 + H2O
\(\overset{t^{\circ } }{\rightarrow}\) SO2 + H2O
Bài 24.3 trang 32 sách bài tập Hóa 8
Oxi trong không khí là đơn chất hay hợp chất? Vì sao cá sống được trong nước? Những lĩnh vực hoạt nào của con người cần thiết phải dùng bình nén oxi để hô hấp?
Hướng dẫn giải bài tập
- Oxi trong không khí là đơn chất.
- Cá sống được trong nước vì trong nước có hòa tan khí oxi.
- Những lĩnh vực hoạt động của của con người cần dùng bình nén oxi để hô hấp: thợ lặn, phi công vũ trụ, bệnh nhân khó thở,…
Bài 24.4 trang 32 sách bài tập Hóa 8
Trong 3 bình giống hệt nhau và có chứa thể tích oxi như nhau. Đồng thời ta cho vào 3 bình: bình 1 một cục than đang cháy, bình 2 hai cục than đang cháy, bình 3 ba cục than đang cháy (các cục than có kích thước như nhau).
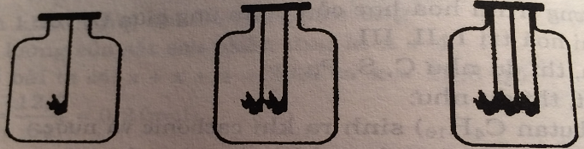
Em hãy nhận xét về hiện tượng xảy ra trong phòng thí nghiệm?
Hướng dẫn giải bài tập
Trong ba hình trên thì cục than ở bình 1 cháy lâu hơn cục than ở bình 2 và cục than ở bình 2 cháy lâu hơn ở bình 3.
Vì lượng oxi trong 3 bình là như nhau.
Bài 24.5 trang 33 sách bài tập Hóa 8
Người và động vật trong quá trình hô hấp hấp thụ O2, thở ra khí CO2. Nguyên liệu xăng, dầu trong quá trình đốt cháy cũng cần O2 và thải CO2. Như vậy lượng O2 phải mất dần, nhưng trong thực tế hang nghìn năm nay, tỉ lệ về thể tích của oxi trong không khí luôn luôn xấp xỉ bằng 20%. Hãy giải thích.
Hướng dẫn giải bài tập
Lượng oxi không mất dần do sự quang hợp của cây xanh đã hấp thụ khí CO2 và tạo ra lượng oxi rất lớn. Do đó tỉ lệ oxi trong khôg khí (tính theo thể tích) luôn luôn xấp xỉ bằng 20%.
Bài 24.6 trang 33 sách bài tập Hóa 8
Có những chất sau: O2, Mg, P, Al, Fe.
Hãy chọn một trong những chất trên và hệ số thích hợp điền vào chỗ trống trong phương trình phản ứng sau:
a) 4Na + ... → 2Na2O
b) .... + 5O2 ![]() \(\overset{t^{\circ } }{\rightarrow}\) 2MgO
\(\overset{t^{\circ } }{\rightarrow}\) 2MgO
c) ... + 5O2 ![]() \(\overset{t^{\circ } }{\rightarrow}\) 2P2O5
\(\overset{t^{\circ } }{\rightarrow}\) 2P2O5
d) ... + 3O2 ![]() \(\overset{t^{\circ } }{\rightarrow}\) 2Al2O3
\(\overset{t^{\circ } }{\rightarrow}\) 2Al2O3
e) ... + ... ![]() \(\overset{t^{\circ } }{\rightarrow}\) Fe3O4
\(\overset{t^{\circ } }{\rightarrow}\) Fe3O4
Hướng dẫn giải bài tập
a) 4Na + O2 → 2Na2O
b) 2Mg + 5O2 ![]() \(\overset{t^{\circ } }{\rightarrow}\) 2MgO
\(\overset{t^{\circ } }{\rightarrow}\) 2MgO
c) 4P + 5O2 ![]() \(\overset{t^{\circ } }{\rightarrow}\) 2P2O5
\(\overset{t^{\circ } }{\rightarrow}\) 2P2O5
d) 4Al + 3O2 ![]() \(\overset{t^{\circ } }{\rightarrow}\) 2Al2O3
\(\overset{t^{\circ } }{\rightarrow}\) 2Al2O3
e) 3Fe+ 2O2 ![]() \(\overset{t^{\circ } }{\rightarrow}\) Fe3O4
\(\overset{t^{\circ } }{\rightarrow}\) Fe3O4
Bài 24.7 trang 33 sách bài tập Hóa 8
Đổ đầy nước vào hộp cat-tông (hộp đựng nước uống Vinamilk) kín, đun hộp đó trên bếp lửa, hộp cát-tông không cháy mà nước lại sôi.
a) Ở nhiệt độ nào thì nước sôi?
b) Trong thời gian nước sôi nhiệt độ có thay đổi không?
c) Vỏ cac-tông cháy ở nhiệt độ trên hay dưới 100oC? Tại sao?
d) Điều gì xảy ra nếu trong hộp không chứa nước?
Hướng dẫn giải bài tập
a) Ở 100oC thì nước sôi.
b) Trong thời gian sôi, nhiệt độ của nước không đổi.
c) Vỏ cát-tông cháy ở nhiệt độ trên 100oC. Vì trong trong hộp có đầy nước, khi trong hết nước thì hộp sẽ cháy.
d) Nếu trong hộp cat-tông hết nước thì vỏ hộp sẽ cháy khi đun hộp trên bếp lửa.
Bài 24.8 trang 33 sách bài tập Hóa 8
Trong giờ học về sự cháy, một học sinh phát biểu: Cây nến cháy và bóng đèn điện cháy, phát biểu đó có đúng hay không?
Hướng dẫn giải bài tập
Câu phát biểu chỉ đúng ch ý đầu: Cây nến cháy vì có phản ứng cháy của nến với khi oxi, còn bóng đèn sang lên không phải là phản ứng cháy mà là dây tóc bóng đèn nóng lên và phát sáng nhờ nguồn điện.
Bài 24.9 trang 33 sách bài tập Hóa 8
a) Cần bao nhiêu gam oxi để đốt cháy hoàn toàn 5 mol cacbon? 5mol lưu huỳnh?
b) Trong giờ thực hành thí nghiệm, một em học sinh đốt cháy 3,2g lưu huỳnh trong 1,12 lit oxi (đktc). Vậy theo em lưu huỳnh cháy hết hay còn dư?
Hướng dẫn giải bài tập
C + O2![]() \(\overset{t^{\circ } }{\rightarrow}\) CO2
\(\overset{t^{\circ } }{\rightarrow}\) CO2
Theo phương trình: 1 1 1 mol
Theo đầu bài: 5 x mol
Số mol của O2 bằng: x = 5.1/1 = 5 mol
Khối lượng O2:
mO2 = nO2.MO2 = 5.32 = 160(g)
S + O2 ![]() \(\overset{t^{\circ } }{\rightarrow}\) SO2
\(\overset{t^{\circ } }{\rightarrow}\) SO2
Theo phương trình: 1 1 1 mol
Theo đầu bài: 5 x mol
Số mol của O2 bằng: x = 5.1/1 = 5 mol
Khối lượng O2:
mO2 = nO2.MO2 = 5.32 = 160(g)
b,
S + O2 ![]() \(\overset{t^{\circ } }{\rightarrow}\) SO2
\(\overset{t^{\circ } }{\rightarrow}\) SO2
Theo phương trình: 1 1 1 mol
Theo phản ứng: 0,1 0,05 mol
nS = 3,2/32 = 0,1 (mol); nO2 = V/22,4 = 1,12/22,4 = 0,05 (mol)
Tỉ lệ mol của S và O2: 0,05/1 < 0,1/1 => O2 hết và S dư
Bài 24.10 trang 33 sách bài tập Hóa 8
Tính thể tích khí oxi và thể tích không khí (đktc) cần thiết để đốt cháy:
a) 1mol cacbon; b) 1,5mol photpho
Cho biết oxi chiếm 20% thể tích không khí.
Hướng dẫn giải bài tập
a) Phương trình phản ứng khi đốt cháy cacbon:
C + O2 → CO2
1 1 1 mol
1 x mol
Số mol oxi là: nO2 = nO2.22,4 = 1.22,4 = 22,4 (lít)
VO2 = nO2.22,4 = 1.22,4 = 22,4(l)
→ Vkk = 5O2 = 5.22,4 = 112(l)
b) Phương trình hóa học khi đốt cháy photpho:
4P + 5O2 ![]() \(\overset{t^{\circ } }{\rightarrow}\) 2P2O5
\(\overset{t^{\circ } }{\rightarrow}\) 2P2O5
Theo phương trình: 4 mol 5 mol 2 mol
Theo đầu bài 1,5 mol x mol
Số mol oxi bằng: nO2 = 1,5.5/4 = 1,875 mol
Thể tích của oxi cần: VO2 = nO2.22,4 = 1,875.22,4 = 42(l)
Thể tích của không khí cần dùng là: Vkk = 5VO2 = 5.42=210(l)
Bài 24.11 trang 34 sách bài tập Hóa 8
Tính khối lượng của N/2 nguyên tử oxi, của N/4 phân tử oxi và so sánh hai kết quả này.
Hướng dẫn giải bài tập
Hai khối lượng này giống nhau.
Vì khối lượng của N nguyên tử O là 16g
Nên khối lượng của N/2 nguyen tử O là 8g
Vậy khối lượng của N phân tử O là 32(g)
Nên khối lượng của N/4 phân tử O là 8(g)
Bài 24.12 trang 34 sách bài tập Hóa 8
Đốt cháy 1 kg than trong khí oxi, biết trong than có 5% tạp chất không cháy.
a) Tính thể tích oxi(đktc) cần thiết để đốt cháy 1kg than trên.
b) Tính thể tích khí cacbonic (đktc) sinh ra trong phản ứng.
Hướng dẫn giải bài tập
Lượng than nguyên chất:
mC = 1000.95/100 = 950 gam
nC = mC/MC = 950/12 = 97,17 (mol)
C + O2 ![]() \(\overset{t^{\circ } }{\rightarrow}\) CO2
\(\overset{t^{\circ } }{\rightarrow}\) CO2
1 1 1
79,17 x y
x = nO2 = 79,17.1/1 = 79,17 mol
y = nC = 79,17 mol
a) VO2 = nO2.22,4 = 79,17.22,4 = 1773,4(l)
b) nCO2 = nO2 = 79,17(mol) → VCO2 = VO2 = 1773,4(l)
Bài 24.13 trang 34 sách bài tập Hóa 8
Người ta dùng đèn xì oxi-axetilen để hàn và cắt kim loại. Phản ứng cháy axetilen C2H2 trong oxi tạo thành khí cacbonic và hơi nước. Hãy tính thể tích khí oxi (đktc) cần thiết để đốt cháy 1 mol khí axetilen.
Hướng dẫn giải bài tập
2C2H2 + 5O2 → 4CO2 + 2H2O
2 5 4 2 mol
1 x mol
nO2 = 1.5/2 = 2,5 mol => VO2 = 1,4.22,4 = 56 lít
Bài 24.14 trang 34 sách bài tập Hóa 8
Hãy cho biết 1,5.1024 phân tử oxi:
a) Là bao nhiêu mol phân tử oxi?
b) Có khối lượng là bao nhiêu gam?
c) Có thể tích là bao nhiêu lit (đktc)?
Hướng dẫn giải bài tập
a) Số mol phân tử oxi:
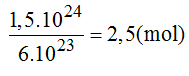
b) Khối lượng của 1,5.1024 phân tử oxi:
mO2 = nO2.MO2 = 2,5.32 = 80(g)
c) Thể tích là: VO2 = nO2.22,4 = 2,5.22,4 = 56(l)
Bài 24.15 trang 34 sách bài tập Hóa 8
a) Trong 16(g) khí oxi có bao nhiêu mol nguyên tử oxi và bao nhiêu mol phân tử oxi?
b) Tính tỉ khối của oxi với nito, với không khí.
Hướng dẫn giải bài tập
a) Trong 16g khí oxi có 1 mol nguyên tử oxi và 0,5 mol phân tử oxi.
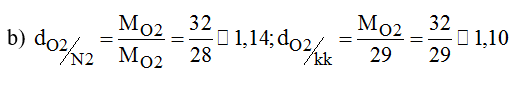
Bài 24.16 trang 34 sách bài tập Hóa 8
Cho 3,36 lit khí oxi (ở đktc) phản ứng hoàn toàn với 1 kim loại hóa trị III thu được 10,2g oxit. Xác định tên kim loại.
Hướng dẫn giải bài tập
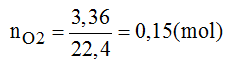
Gọi A là kí hiệu của kim loại có hóa trị III, MA là nguyên tử khối của A.
Ta có PTHH:
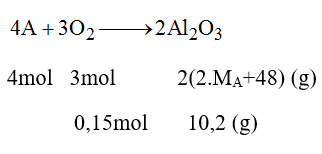
Theo PTHH trên ta có:
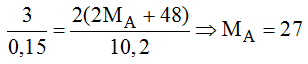
Vậy A là nhôm.
Bài 24.17 trang 34 sách bài tập Hóa 8
Để đốt cháy 1 mol chất X cần 6,5 mol O2, thu được 4 mol khí cacbonic và 5 mol nước. Xác định công thức phân tử của X.
Hướng dẫn giải bài tập
Theo đề bài, ta có PTHH:
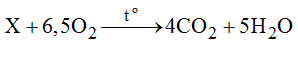
Theo định luật bảo toàn khôi lượng: thì ta có:
1mol chất X phải có 4 mol C (4 mol CO2), 10 mol H (5mol H2O) và không chứa oxi (vì 2 vế của PTHH sô mol nguyên tử oxi bằng nhau). Vậy công thức hóa học của phân tử X là C4H10.
Bài 24.18 trang 34 sách bài tập Hóa 8
Đốt cháy hoàn toàn 6,2 g photpho trong bình chứa 8,96 lit khi oxi (ở đktc), sản phẩm thu được là chất rắn, màu trắng. Nếu hiệu suất phản ứng là 80% thì khối lượng chất rắn thu được là bao nhiêu?
Hướng dẫn giải bài tập
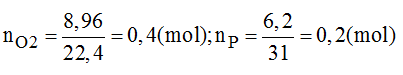
PTHH của phản ứng:
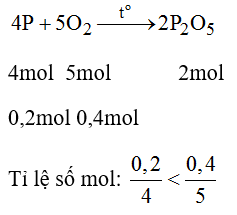
→ Oxi dư, vậy bài toán tính theo số mol của P
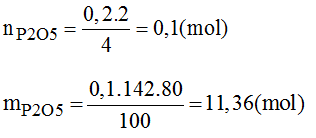
Bài 24.19 trang 34 sách bài tập Hóa 8
Đốt cháy một hỗn hợp gồm bột Fe và Mg, trong đó Mg có khối lựng 0,48g cần dùng 672ml O2 (ở đktc). Hãy tính khối lượng kim loại Fe.
Hướng dẫn giải bài tập
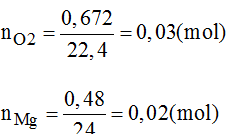
PTHH của phản ứng:
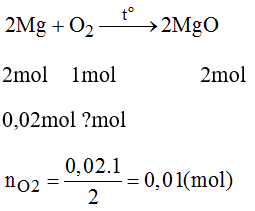
nO2 còn lại tác dụng Fe với O2:
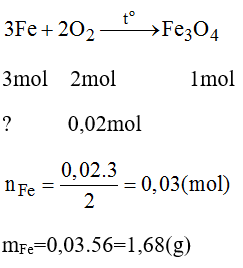
..............................................
Để có kết quả cao hơn trong học tập, VnDoc xin giới thiệu tới các bạn học sinh tài liệu Chuyên đề Toán 8, Chuyên đề Vật Lý 8, Chuyên đề Hóa 8, Tài liệu học tập lớp 8 mà VnDoc tổng hợp và đăng tải.
Ngoài ra, VnDoc.com đã thành lập group chia sẻ tài liệu học tập THCS miễn phí trên Facebook: Tài liệu học tập lớp 8. Mời các bạn học sinh tham gia nhóm, để có thể nhận được những tài liệu mới nhất.







