Hóa 8 Bài 26: Oxit
Hóa học 8 Bài 26: Oxit được VnDoc biên soạn tóm tắt trọng tâm nội dung Bài 26: Oxit, được chia thành các phần nội dung nhỏ kèm theo các ví dụ minh họa về oxit giúp các bạn học sinh dễ theo dõi ghi nhớ.
Bài 26 Hóa 8: Oxit
Hy vọng với tài liệu này giúp các bạn học sinh học tốt hơn cũng như giúp ích cho quý thầy cô trong quá trình soạn giảng Hóa 8 bài 26 của mình. Mời các bạn tham khảo
I. Lý thuyết hóa 8 bài 26 Oxit
1. Định nghĩa oxit
- Oxit là hợp chất tạo bởi hai nguyên tố, trong đó có một nguyên tố là oxi
- CTTQ:
MxOy: Gồm có kí hiệu oxi O kèm theo chỉ số y và kí hiệu nguyên tố M (có hóa trị n) chỉ số x, theo quy tắc hóa trị ta có:
2. y = n . x
2. Phân loại oxit
Chia thành 2 loại chính
a) Oxit axit
Thường là oxit của phi kim tương ứng với một axit.
Ví dụ:
CO2 tương với axit H2CO3
SO3 tương ứng với H2SO4
P2O5 tương ứng với H3PO4
b) Oxit bazơ
Thường là oxit của kim loại tương ứng với một bazơ
Ví dụ:
Na2O tương ứng với bazơ NaOH
Cu2O tương ứng với bazơ Cu(OH)2
2. Cách gọi tên
![]()
Ví dụ:
BaO: Bari oxit
NO : nito oxit
- Nếu kim loại có nhiều hóa trị: Fe( II, III)…
![]()
Ví dụ:
F2O3 - Sắt (III) oxit
FeO - Sắt (II) oxit
- Nếu phi kim có nhiều hòa trị: N (II, III, IV...)
Tên oxit:
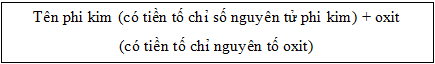
1: mono 2: đi 3: tri 4: tetra 5: penta
Ví dụ:
CO - cacbon monoxit, đơn giản cacbon oxit
CO2 - cacbon đioxit, cách gọi khác (cacbonnic)
II. Bài tập vận dụng, mở rộng
1. Bài tập trắc nghiệm
Câu 1. Oxit là:
A. Hỗn hợp của nguyên tố oxi với một nguyên tố khác.
B. Hợp chất của nguyên tố phi kim với một nguyên tố hóa học khác.
C. Hợp chất của oxi với một nguyên tố hóa học khác.
D. Hợp chất của nguyên tố kim loại với một nguyên tố hóa học khác.
Câu 2. Oxit axit là:
A. Những oxit tác dụng với dung dịch axit tạo thành muối và nước.
B. Những oxit tác dụng với dung dịch bazơ tạo thành muối và nước.
C. Những oxit không tác dụng với dung dịch axit và dung dịch bazơ.
D. Những oxit chỉ tác dụng được với muối.
Câu 3. Oxit bazơ là:
A. Những oxit tác dụng với dung dịch axit tạo thành muối và nước.
B. Những oxit tác dụng với dung dịch bazơ tạo thành muối và nước.
C. Những oxit không tác dụng với dung dịch axit và dung dịch bazơ.
D. Những oxit chỉ tác dụng được với muối.
Câu 4: Trong x gam quặng sắt hematit có chứa 5,6g Fe. Khối lượng Fe2O3 có trong quặng đó là:
A. 6g
B. 7g
C. 8g
D. 9g
Câu 5: Trong oxit, kim loại có hoá trị III và chiếm 70% về khối lượng là:
A. Cr2O3
B. Al2O3
C. As2O3
D. Fe2O3
Câu 6. Chất tác dụng với nước tạo ra dung dịch bazơ là:
A. CO2
B. Na2O
C. SO2
D. P2O5
Câu 7. Chất tác dụng với nước tạo ra dung dịch axit là:
A. K2O
B. CuO
C. P2O5
D. CaO
Câu 8. Chất tác dụng với nước tạo ra dung dịch bazơ là:
A. K2O
B. CuO
C. CO
D. SO2
Câu 9. Chất tác dụng với nước tạo ra dung dịch axit là:
A. CaO
B. BaO
C. Na2O
D. SO3
Câu 10. Chất khí nào sau đây là nguyên nhân gây ra hiệu ứng nhà kính?
A. CO2
B. O2
C. N2
D. H2
Câu 11. Tên gọi của oxit Cr2O3 là
A. Crom oxit
B. Crom (II) oxit
C. Đicrom trioxit
D. Crom (III) oxit
Câu 12. Tên gọi của oxit N2O5 là
A. Đinitơ pentaoxit
B. Đinitơ oxit
C. Nitơ (II) oxit
D. Nitơ (II) pentaoxit
Câu 13. Sắt (III) oxit (Fe2O3) tác dụng được với
A. Muối tạo ra muối
B. Bazơ, sản phẩm là muối và nước.
C. Nước, sản phẩm là bazơ
D. Axit, sản phẩm là muối và nước.
Câu 14. Công thức hóa học của sắt oxit, biết Fe (III) là:
A. Fe2O3
B. Fe3O4
C. FeO
D. Fe3O2
Câu 15. Dãy chất sau đây chỉ gồm các oxit:
A. MgO; Ba(OH)2; CaSO4; HCl
B. MgO; CaO; CuO; FeO
C. SO2; CO2; NaOH; CaSO4
D. CaO; Ba(OH)2; MgSO4; BaO
2. Đáp án hướng dẫn giải
| 1C | 2B | 3A | 4C | 5D | 6B | 7C | 8A |
| 9D | 10A | 11D | 12A | 13D | 14A | 15B |
Câu 4.
nFe = 0,1 mol
Cứ 1 phân tử Fe2O3 chứa 2Fe
=> nFe2O3 = 0,1/2 = 0,05 mol
mFe2O3 = 0,05.160 = 8 gam
Câu 5.
Gọi CTHH của oxit hóa trị III là R2O3
Ta có R chiếm 70% khối lượng:
%mR = ![]() \(\frac{{2R}}{{2R + 48}}.100\% = 70\%\)
\(\frac{{2R}}{{2R + 48}}.100\% = 70\%\)
=> R = 56 => Kim loại Fe
Công thức hóa học của oxit: Fe2O3
3. Bài tập tự luận
Bài 1: A, B là 2 chất khí ở điều kiện thường, A là hợp chất của nguyên tố X với oxi (trong đó oxi chiếm 50% khối lượng), còn B là hợp chất của nguyên tố Y với hiđro (trong đó hiđro chiếm 25% khối lượng). Tỉ khối của A so với B bằng 4. Xác định công thức phân tử A, B. Biết trong 1 phân tử A chỉ có một nguyên tử X, 1 phân tử B chỉ có một nguyên tử Y.
Đáp án hướng dẫn giải chi tiết
A tạo bởi 1 nguyên tử X với O nên có dạng XOn
→ MXOn = MX + nMO = MX + 16n
B tạo bởi 1 nguyên tử Y với H nên có dạng YHm
→ MB = MY + mMH = MY + m
→%mO = 16n/(MX + 16n) =50%
→ MX + 16n = 32n
→ MX = 16n
Thỏa mãn n = 2 → MX = 32→ X: S
Vậy A là SO2
→ MA = 64 → MB = MA/4 = 16
→ MY + m = 16
→ %mH = mMY + m= m/16 = 25% → m = 4 → MY = 12
Bài 2: Một oxit của kim loại M có %M = 63,218. Tìm công thức oxit.
Bài 3: Một oxit (A) của nitơ có tỉ khối hơi của A so với không khí là 1,59. Tìm công thức oxit A.
Bài 4: Khử 9,6g một hỗn hợp gồm Fe2O3 và FeO bằng H2 ở nhiệt độ cao, người ta thu được Fe và 2,88g H2O.
a/ Viết các PTHH xảy ra.
b/ Xác định thành phần % của 2 oxit trong hỗn hợp.
c/ Tính thể tích H2 (đktc) cần dùng để khử hết lượng oxit trên.
Đáp án hướng dẫn giải chi tiết
Fe2O3 + 3H2 → Fe + 3H2O (nhiệt độ) (1)
FeO + H2 → Fe + H2O (nhiệt độ) (2)
b) Gọi nFe2O3 = a , nFeO = b trong 9,6 g hh
==> 160a +72b = 9,6 (I)
Theo phương trìn (1),(2) tổng số mol của nH2O = 3 nFe2O3 + nFeO = 3a + b = 2,88/18 = 0,16 (ll)
Từ (l), (ll) => a= 0,034 và b=0,058
mFe2O3 = 5,44 (g)
%mFe2O3 = 5,44/9,6. 100%= 56,67%
%mFeO=100% - 56,67% = 43,33%
c) Theo phương trình (1),(2) nH2 = nH2O = 0,16 (mol)
==> VH2 = 0,16 . 22,4 =3,584 (l) (đktc)
Bài 5: Tính phần trăm khối lượng của mỗi nguyên tố trong các hợp chất: CaO, SO2, P2O5, NO, K2O. Trong một oxit của kim loại R (hóa trị I), nguyên tố oxi chiếm 25,806% về khối lượng. Tìm công thức phân tử và gọi tên của oxit trên.
III. Giải bài tập Hóa 8 bài Bài 26: Oxit
Để giúp các bạn học sinh có thể hoàn thành tốt các dạng bài tập sách giáo khoa cũng như biết cách vận dụng kiến thức đã học của bài áp dụng vào các dạng bài tập, từ đó nâng cao,rèn luyện kĩ năng thao tác giải bài tập. VnDoc đã biên soạn hướng dẫn giải bài tập hóa 8 sách giáo khoa bài 26 tại: Giải Hóa 8 bài 26: Oxit
........................
Mời các bạn tham khảo thêm một số tài liệu liên quan:
Để có kết quả cao hơn trong học tập, VnDoc xin giới thiệu tới các bạn học sinh tài liệu Chuyên đề Toán 8, Chuyên đề Vật Lý 8, Chuyên đề Hóa 8, Tài liệu học tập lớp 8 mà VnDoc tổng hợp và đăng tải.
Ngoài ra, VnDoc.com đã thành lập group chia sẻ tài liệu học tập THCS miễn phí trên Facebook: Tài liệu học tập lớp 8. Mời các bạn học sinh tham gia nhóm, để có thể nhận được những tài liệu mới nhất.








