Giải SBT Hóa 8 bài 11: Luyện tập chương 1
Giải SBT Hóa 8 bài 11: Luyện tập chương 1 tổng hợp lời giải chi tiết, rõ ràng các câu hỏi trong vở bài tập Hóa học lớp 8, các bài giải tương ứng với từng bài học trong sách giúp cho các em học sinh ôn tập và củng cố các dạng bài tập, rèn luyện kỹ năng giải môn Hóa lớp 8. Chúc các em học tốt.
Để có thể hoàn thành tốt các dạng bài tập sách bài tập hóa 8 bài 11, các bạn học sinh cần nắm chắc nội dung kiến thức các bài học trước đó, về hóa trị, các nguyên tố hóa học. Nội dung tóm tắt các bài học được VnDoc biên soạn tại: Hóa học 8 Bài 8: Bài luyện tập số 1
A. Giải sách bài tập Hóa 8 bài 11
Bài 11.1 trang 15 SBT Hóa 8
Viết sơ đồ công thức hóa học của các hợp chất sau:
H2S; PH3; CO2; SO3.
Đáp án hướng dẫn giải chi tiết
a) H2S: H-S-H
b, PH3
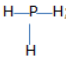
c) CO2: O = C = O
d, SO3
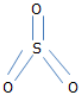
Bài 11.2 trang 15 SBT Hóa 8
Cho biết công thức hóa học hợp chất của nguyên tố X với nhóm (SO4) và hợp chất của nhóm nguyên tử Y với H như sau: X2(SO4)3; H3Y
Hãy chọn công thức hóa học nào là đúng cho hợp chất của X và Y trong số các công thức cho sau đây:
|
XY2 |
Y2X |
XY |
X2Y2 |
X3Y2 |
|
(a) |
(b) |
(c) |
(d) |
(e) |
Đáp án hướng dẫn giải chi tiết
Vì trong X2(SO4)3 → X có hóa trị III.
Và trong H3Y → Y có hóa trị III.
→ Chọn C.
Bài 11.3 trang 15 SBT Hóa 8
Lập công thức hóa học và tính phân tử khối của các hợp chất có phân tử Na, Cu(II) và Al lần lượt liên kết với:
a) Brom Br(I).
b) Lưu huỳnh S(II).
Đáp án hướng dẫn giải chi tiết
a) Với Br:
* Na và Br(I): Ta có: NaIx(BrI)y
Theo quy tắc: I.x = I.y
Tỉ lệ: x:y = I:I => x = 1, y = 1
Vậy công thức hóa học của Nax(Br)y là NaBr.
Phân tử khối của NaBr: 23 + 80 = 103 đvC
* Cu(II) và Br(I): Ta có: ![]()
Theo quy tắc: x.II = I.y → 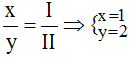
Vậy công thức hóa học của CuxBry là CuBr2.
Phân tử khối của CuBr2 = 64 + 80.2 = 224 đvC
* Al và Br (I): Ta có: ![]()
Theo quy tắc: III.x = I.y → 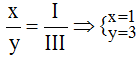 .
.
Vậy công thức hóa học của Alx(Br)y là Al(Br)3.
Phân tử khối của Al(Br)3: 27 + 80.3 = 267 đvC
b) Với S:
* Na và S(II): Ta có: ![]()
Theo quy tắc: x.I = II.y → 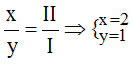 .
.
Vậy công thức hóa học của NaxSy là Na2S.
Phân tử khối = 23.2 + 32 = 78 đvC
* Al và S(II): Ta có: ![]()
Theo quy tắc: x.III = y.II → 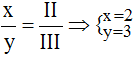 .
.
Vậy công thức của AlxSy là Al2S3.
Phân tử khối = 27.2 + 32.3 = 150 đvC
* Cu(II) và S(II): Ta có: ![]()
Theo quy tắc: II.x = II.y → 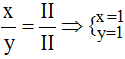 .
.
Vậy công thức hóa học của CuxSy là CuS.
Phân tử khối = 64 + 32 = 96 đvC
Bài 11.4 trang 16 SBT Hóa 8
Lập công thức hóa học và tính phân tử khối của các hợp chất có phân tử gồm Ag(I), Mg, Zn và Fe(III) lần lượt liên kết với:
a) Nhóm (NO3).
b) Nhóm (PO4).
Đáp án hướng dẫn giải chi tiết
a) Nhóm (NO3):
* Ag và (NO3): Ta có: ![]()
Theo quy tắc: x.I = y.I → 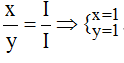 .
.
Vậy công thức hóa học của Agx(NO3)y là AgNO3.
Phân tử khối = 108 + 14 + 16.3 = 170 đvC
* Mg và (NO3): Ta có: ![]()
Theo quy tắc: x.II = I.y → 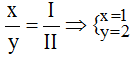 .
.
Vậy công thức hóa học của Mgx(NO3)y là Mg(NO3)2.
Phân tử khối của Mg(NO3)2 = 24 + 2.(14 + 16.3) = 148 đvC
* Zn và (NO3): Ta có: ![]()
Theo quy tắc: x.II = I.y → 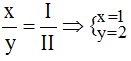 .
.
Vậy công thức hóa học của Znx(NO3)y là: Zn(NO3)2.
Phân tử khối = 65 + 2.(14+ 16.3) = 189 đvC
* Fe (III) và (NO3): Ta có: 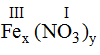
Theo quy tắc: x.III = y.I → 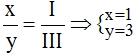 .
.
Vậy công thức hóa học của Fex(NO3)y là Fe(NO3)3.
Phân tử khối = 56 + 3.(14 + 16.3) = 242 đvC
b) Nhóm (PO4):
* Ag và (PO4): Ta có: ![]()
Theo quy tắc: x.I = III.y → 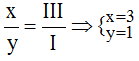
Vậy công thức hóa học của Agx(PO4)y là Ag3PO4
Phân tử khối = 108.3 + 31 + 16.4 = 419 đvC
* Mg và (PO4): Ta có: ![]()
Theo quy tắc: x.I = III.y → 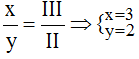
Vậy công thức hóa học là Mg3(PO4)2
Phân tử khối = 24.3 + 2.(31 + 16.4) = 385 đvC
* Fe(III) và (PO4): Ta có: ![]()
Theo quy tắc: x.III = y.III → 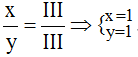 .
.
Vậy công thức hóa học là FePO4.
Phân tử khối của FePO4 = 56 + 31 + 16.4 = 151 đvC
Bài 11.5 trang 16 SBT Hóa 8
Công thức hóa học của một số hợp chất của nhôm viết như sau: AlCl4; AlNO3; Al2O3; AlS; Al3(SO4)2; Al(OH)2; Al2(PO4)3.
Biết rằng trong các số này chỉ một công thức đúng và S có hóa trị II hãy sửa lại những công thức sai.
Đáp án hướng dẫn giải chi tiết
- Công thức hóa học đúng là Al2O3.
- Các công thức còn lại là sai. Sửa lại cho đúng: AlCl3; Al(NO3)3; Al2S3; Al2(SO4)3; Al(OH)3; AlPO4.
Bài 11.6* trang 16 SBT Hóa 8
Cho biết tổng số các hạt proton, nơtron, electron tạo nên một nguyên tử một nguyên tố bằng 49, trong đó số hạt không mang điện là 17.
a) Tính số p và số e có trong nguyên tử.
b) Viết tên, kí hiệu hóa học và nguyên tử khối của nguyên tố.
c) Vẽ sơ đồ đơn giản của nguyên tử.
Số lớp electron và số electron lớp ngoài cùng có gì giống và khác so với nguyên tử O? (Xem sơ đồ nguyên tử này trong bài 4. Nguyên tử - SGK).
Đáp án hướng dẫn giải chi tiết
Trong 1 nguyên tử có số p = số e và nơtron là hạt không mang điện.
Theo đề bài, ta có:
Số p = số e = (49 - 17)/2 =16.
Vậy số p và số e bằng 16.
b) Nguyên tố này là lưu huỳnh, kí hiệu S, nguyên tử khối là 32 đvC.
c) Sơ đồ đơn giản của nguyên tử S:
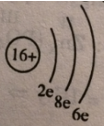
Nguyên tử lưu huỳnh có 3 lớp electron:
- Khác: với nguyên tử O chỉ có 2 lớp electron.
- Giống: với nguyên tử O là có cùng 6e ở lớp ngoài cùng.
Bài 11.7* trang 16 SBT Hóa 8
Một số hợp chất của nguyên tố T hóa trị III vơi nguyên tố oxi, trong đó T chiếm 53% về khối lượng.
a) Xác định nguyên tử khối và tên nguyên tố T.
b) Viết công thức hóa học và tính phân tử khối của hợp chất.
Đáp án hướng dẫn giải chi tiết
a) Gọi công thức của hợp chất là T2O3 và a là nguyên tử khối của T.
Theo đề bài, ta có:
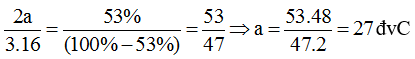
Nguyên tố T là nhôm.
b) Công thức hóa học của hợp chất là Al2O3.
Phân tử khối: 27.2 + 16.3 = 102 đvC.
Bài 11.8* trang 16 SBT Hóa 8
Hợp chất A tạo bởi hidro và nhóm nguyên tử (XOx) hóa trị III.
Biết rằng phân tử A nặng bằng phân tử H2SO4 và nguyên tố oxi chiếm 65,31% về khối lượng a.
a) Xác định chỉ số y và nguyên tử khối của nguyên tố X.
b) Viết tên, kí hiệu hóa học của X và công thức hóa học của A.
Đáp án hướng dẫn giải chi tiết
a) Gọi công thức của A là H3XOy.
Phân tử khối của A: 2 + 32 + 16.4 = 98 (đvC) (Vì A nặng bằng phân tử H2SO4)
Theo đề bài, ta có:
16y = (65,31.98/100) = 64 (đvC)
→ y = 64/16 = 4 → có 4 nguyên tử oxi trong hợp chất A.
Vậy nguyên tử khối của X là: 98 – (3 + 64) = 31 (đvC)
b) Tên nguyên tố là photpho, kí hiệu hóa học là P.
Công thức hóa học của A là H3PO4.
>> Mời các bạn tham khảo thêm giải bài tập sách bài tập hóa 8 bài tiếp theo tại: Giải SBT Hóa 8 bài 12: Sự biến đổi chất
B. Giải Hóa 8 bài 11
Giúp các bạn học sinh hoàn thành tốt các bài tập sgk hóa 8 bài 10 Hóa trị, VnDoc đã biên soạn hướng dẫn giải các bài tâp SGK một cách chi tiết dễ hiểu nhất để gửi tại bạn đọc tại: Giải bài tập Hóa 8 bài 10 Hóa trị: Giải Hóa 8 bài 11: Bài luyện tập 2
C. Trắc nghiệm hóa 8 bài 11
Ngoài các dạng câu hỏi bài tập sách bài tập, cũng như sách giáo khoa. Để rèn luyện kĩ năng cũng như củng cố kiến thức nội dung bài học trên lớp. VnDoc biên soạn bộ câu hỏi trắc nghiệm Hóa 8 bài 11 gồm 15 câu hỏi trắc nghiệm khách quan, kèm đáp án giúp thuận tiện trong quá trình làm bài. Mời các bạn tham khảo nội dung tại: Trắc nghiệm Hóa học 8 bài 11
.................................
Mời các bạn tham khảo thêm một số tài liệu liên quan:
- Hóa học 8 Bài 12: Sự biến đổi chất
- Giải bài tập SBT Hóa học lớp 8 bài 12: Sự biến đổi chất
- Trắc nghiệm Hóa học 8 bài 11
Trên đây VnDoc đã đưa tới các bạn Giải SBT Hóa 8 bài 11: Luyện tập chương 1. Để có kết quả cao hơn trong học tập, VnDoc xin giới thiệu tới các bạn học sinh tài liệu Chuyên đề Toán 8, Chuyên đề Vật Lý 8, Chuyên đề Hóa 8, Tài liệu học tập lớp 8 mà VnDoc tổng hợp và đăng tải.
Ngoài ra, VnDoc.com đã thành lập group chia sẻ tài liệu học tập THCS miễn phí trên Facebook: Tài liệu học tập lớp 8. Mời các bạn học sinh tham gia nhóm, để có thể nhận được những tài liệu mới nhất.







