Kim loại sắt không phản ứng được với dung dịch nào sau đây
Kim loại Fe không phản ứng được với dung dịch
Kim loại sắt không phản ứng được với dung dịch nào sau đây được biên soạn hướng dẫn bạn đọc trả lời câu hỏi liên quan đến sắt không phản ứng được với dung dịch nào sau đây. Cũng như đưa ra các nội dung lý thuyết liên quan đến tính chất hóa học của Sắt. Hy vọng thông qua nội dung câu hỏi này sẽ giúp ích cho bạn đọc trong quá trình học tập, vận dụng giải bài tập.
Kim loại sắt không phản ứng được với dung dịch nào sau đây
A. ZnCl2.
B. FeCl3.
C. H2SO4 loãng, nguội.
D. AgNO3
Đáp án hướng dẫn giải chi tiết

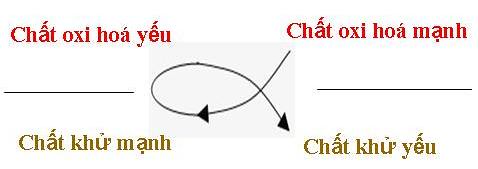
Theo quy tắc α, dễ thấy Fe không phản ứng được với dung dịch ZnCl2.
Đáp án A
Tính chất hóa học của Sắt
1. Sắt tác dụng với phi kim
+ Khi đun nóng sắt tác dụng với hầu hết phi kim.
1.1. Sắt tác dụng với oxi
3Fe + 2O2 ![]() \(\overset{t^{o} }{\rightarrow}\)Fe3O4
\(\overset{t^{o} }{\rightarrow}\)Fe3O4
Fe3O4 là oxit sắt từ, là oxit của hỗn hợp sắt có hóa trị II và III: FeO và Fe2O3
1.1. Sắt tác dụng với phi kim khác.
2Fe + 3Cl2 ![]() \(\overset{t^{o} }{\rightarrow}\)2FeCl3
\(\overset{t^{o} }{\rightarrow}\)2FeCl3
Ngoài Oxi (O) và Lưu huỳnh (S), sắt có thể tác dụng được với nhiều phi kim khác như Cl2, Br2,… tạo thành muối.
2. Sắt tác dụng với Axit
Sắt tác dụng với HCl, H2SO4 loãng tạo thành muối sắt (II) và giải phóng H2.
Fe + 2HCl loãng → FeCl2 + H2↑
Fe + 2H2SO4 loãng → FeSO4 + H2↑
Chú ý: Sắt Fe không phản ứng với axit HNO3 đặc, nguội và axit H2SO4 đặc, nguội; do ở nhiệt độ thường, sắt tạo ra lớp oxit bảo vệ kim loại trở nên “thụ động”, không bị hòa tan.
Sắt tác dụng với HNO3 đặc nóng, H2SO4 đặc nóng tạo thành muối sắt III
Fe + H2SO4 đặc,nóng → Fe2(SO4)3 + 3SO2 + 6H2O
Fe + 6HNO3 đặc,nóng → Fe(NO3)3 + 3NO2 + H2O
3. Tác dụng với dung dịch muối
Sắt tác dụng với dung dịch muối của những kim loại kém hoạt động hơn trong dãy điện hoá, tạo thành dung dịch muối sắt và giải phóng kim loại trong muối
Fe + CuSO4 → FeSO4 + Cu
Câu hỏi vận dụng liên quan
Câu 1. Kim loại sắt không phản ứng được với dung dịch nào sau đây?
A. H2SO4 loãng
B. HNO3 loãng
C. HNO3 đặc nguội
D. H2SO4 đặc nóng
Fe bị thụ động hóa trong HNO3 đặc nguội và H2SO4 đặc nguội nên Fe không phản ứng được với hai loại axit này.
Câu 2. Sắt không phản ứng được với dung dịch nào sau đây
A. HNO3 đặc, nguội.
B. H2SO4 đặc, nóng.
C. HNO3 loãng.
D. H2SO4 loãng.
Câu 3. Sắt tác dụng được với muối nào sau đây?
A. Zn(NO3)2.
B. Mg(NO3)2.
C. CuSO4.
D. KCl.
Đáp án A, B, D: Kim loại trong các muối này đều hoạt động mạnh hơn sắt vì thế sắt không tác dụng.
Kim loại đồng hoạt động kém hơn sắt nên phản ứng xảy ra:
Fe + CuSO4 → FeSO4 + Cu
Câu 4. Đốt một lượng dư sắt trong khí clo thu được hỗn hợp gồm 2 chất rắn. Thành phần chất rắn đó gồm
A. FeCl2 và FeCl3.
B. FeCl3 và Fe.
C. FeCl2 và Fe.
D. đáp án khác.
Fe dư => chất rắn sau phản ứng chứa Fe dư và muối Fe(III)
Dễ nhầm sang trường hợp tạo muối Fe(II) và sắt dư: Fe+ Fe(III) → Fe(II)
Tuy nhiên phản ứng này chỉ xảy ra trong dung dịch nên => Fe dư thì sản phẩm là muối Fe(III) và Fe dư
Câu 5. Cho 11,2 gam bột sắt tác dụng với khí clo dư. Sau phản ứng thu được 32,5 gam muối sắt. Khối lượng khí clo tham gia phản ứng là
A. 21,3 gam.
B. 20,5 gam.
C. 10,55 gam.
D. 10,65 gam.
Phương trình hóa học:
2Fe + 3Cl2 → 2FeCl3
Áp dụng định luật bảo toàn khối lượng: mFe + mCl2 = mFeCl3
=> mCl2 = mFeCl3 – mFe = 32,5 – 11,2 = 21,3 gam.
Câu 6. Sắt vừa thể hiện hóa trị II, vừa thể hiện hóa trị III khi tác dụng với
A. Cl2.
B. dung dịch HCl.
C. O2.
D. S.
Sắt vừa thể hiện hóa trị II, vừa thể hiện hóa trị III khi tác dụng với O2
Phương trình hóa học
3Fe + 2O2 → Fe3O4
------------------------------------
Trên đây VnDoc.com đã giới thiệu tới bạn đọc tài liệu: Kim loại sắt không phản ứng được với dung dịch nào sau đây. Để có kết quả cao hơn trong học tập, VnDoc xin giới thiệu tới các bạn học sinh tài liệu Hóa học lớp 10, Giải bài tập Hóa học lớp 11, Hóa học lớp 12, Thi thpt Quốc gia môn Toán, đề thi học kì 1 lớp 11, đề thi học kì 2 lớp 11 mà VnDoc tổng hợp và đăng tải.
Để thuận tiện cho các bạn học sinh trong quá trình trao đổi cũng như cập nhật thông tin tài liệu mới nhất, mời bạn đọc cùng tham gia nhóm Tài liệu học tập lớp 12 để có thêm tài liệu học tập nhé




