Đề thi hóa 8 giữa học kì 2 năm học 2020 - 2021 Đề 5
Đề kiểm tra học giữa học kì 2 Hóa 8 Có đáp án
Đề thi hóa 8 giữa học kì 2 năm học 2020 - 2021 Đề 5 được VnDoc biên soạn là đề kiểm tra giữa học kì 2 hóa 8, giúp đánh giá học lực của các bạn học sinh thông qua bài thi giữa kì, nội dung đề thi gồm 5 câu hỏi tự luận, đảm bảo đánh giá đúng các kĩ năng, thông hiểu, vận dụng, vận dụng cao. Mời các bạn tham khảo.
- Đề thi giữa học kì 2 môn Hóa học lớp 8 năm học 2020 - 2021 Đề 2
- Đề thi hóa 8 giữa học kì 2 năm học 2020 - 2021 Đề 3
- Đề thi hóa 8 giữa học kì 2 năm học 2020 - 2021 Đề 4
ĐỀ KIỂM TRA GIỮA HỌC KÌ 2 MÔN HÓA HỌC 8
Bản quyền thuộc về VnDoc nghiêm cấm mọi hành vi sao chép vì mục đích thương mại
Đề số 5
Câu 1. Hoàn thành các PTHH (ghi rõ điều kiện phản ứng nếu có)
FeO + HCl →
P + O2 →
KMnO4 →
CaO + H2O →
Al + O2 →
C2H6 + O2 →
Câu 2. Điền các thông tin còn thiếu vào bảng sau:
| STT | CTHH | Phân loại | Tên gọi |
| 1 | Canxi oxit | ||
| 2 | N2O5 | ||
| 3 | Lưu huỳnh trioxit | ||
| 4 | Al2O3 | ||
| 5 | Sắt (III) oxit |
Câu 3. Hình vẽ dưới đây mô tả thí nghiệm điều chế khí oxi trong phòng thí nghiệm. Điền các cụm từ thích hợp vào chỗ trống để được nhận xét đúng.
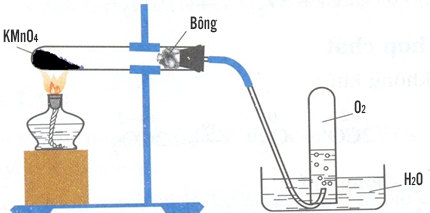
Chất rắn X có thể là ............................. Khí oxi thu được bằng cách đẩy nước vì .............
Phương trình hóa học của phản ứng là: ....................................................
Câu 4. Đốt cháy 6,4 gam lưu huỳnh trong bình chứa 3,36 lít khí oxi (đktc). Sau phản ứng thu được khí sunforơ SO2
a) Viết phương trình phản ứng xảy ra
b) Chất nào còn dư sau phản ứng? Lượng dư là bao nhiêu?
c) Tính khối lượng khí sunfurơ thu được sau phản ứng.
Câu 5. Đốt nóng 2,4 gam kim loại M trong khí oxi dư, thu được 4,0 gam chất rắn. Xác định kim loại M.
------------Hết-------------
Câu 1.
FeO + 2HCl → FeCl2 + H2O
4P + 5O2 → 2P2O5
2KMnO4 ![]() \(\overset{t^{\circ } }{\rightarrow}\) K2MnO4 + MnO2 + O2
\(\overset{t^{\circ } }{\rightarrow}\) K2MnO4 + MnO2 + O2
CaO + H2O → Ca(OH)2
4Al + 3O2 → 2Al2O3
C2H6 + 7/2O2 → 2CO2 + 3H2O
Câu 2.
| STT | CTHH | Phân loại | Tên gọi |
| 1 | CaO | Oxit bazo | Canxi oxit |
| 2 | N2O5 | Oxit axit | Đinito pentaoxit |
| 3 | SO3 | Oxit axit | Lưu huỳnh trioxit |
| 4 | Al2O3 | Oxit bazo | Nhôm oxit |
| 5 | Fe2O3 | Oxit bazo | Sắt (III) oxit |
Câu 3.
Chất rắn X có thể là KMnO4 hoặc KClO3. Khí oxi thu được bằng cách đẩy nước vì khí oxi ít tan trong nước.
Phương trình hóa học của phản ứng là
2KMnO4 ![]() \(\overset{t^{\circ } }{\rightarrow}\) K2MnO4 + MnO2 + O2
\(\overset{t^{\circ } }{\rightarrow}\) K2MnO4 + MnO2 + O2
2KClO3 ![]() \(\overset{t^{\circ } }{\rightarrow}\) 2KCl + 3O2
\(\overset{t^{\circ } }{\rightarrow}\) 2KCl + 3O2
Câu 4.
a) Phương trình hóa học : S + O2 ![]() \(\overset{t^{\circ } }{\rightarrow}\) SO2
\(\overset{t^{\circ } }{\rightarrow}\) SO2
b) Theo đề bài: 0,1 0,15 0 (mol)
Phản ứng: 0,1 0,1 0,1 (mol)
Sau phản ứng: 0 0,05 0,1 (mol)
b) Số mol lưu huỳnh: nS = mS/MS = 6,4/64 = 0,1 (mol)
Số mol oxi: nO2 = VO2/22,4 = 3,36/22,4 = 0,15 (mol)
c) Khối lượng khí sunfuro thu được bằng: mSO2 = 0,1.64 = 6,4 gam
Câu 5.
Gọi hóa trị M là n (ĐK: n nguyên dương)
Sơ đồ phản ứng: M + O2 ![]() \(\overset{t^{\circ } }{\rightarrow}\) M2On
\(\overset{t^{\circ } }{\rightarrow}\) M2On
Áp dụng định luật bảo toàn khối lượng:
mM + mO2 = mM2On => 2,4 + 32.nO2 = 4,0 => nO2 = 0,05 mol
Phương trình hóa học của phản ứng:
4M + nO2 ![]() \(\overset{t^{\circ } }{\rightarrow}\) 2M2On
\(\overset{t^{\circ } }{\rightarrow}\) 2M2On
0,05.4/n 0,05
Số mol kim loại M bằng: nM = 0,2/n mol
Khối lượng kim loại M: mM = nM.M => 2,4 = 0,2/n.M => M = 12n
Lập bảng:
| n | 1 | 2 | 3 |
| M | 12 (loại) | 24 (Mg) | 36 (loại) |
Vậy kim loại M là Mg
...............
Trên đây VnDoc đã gửi tới bạn đọc Đề thi hóa 8 giữa học kì 2 năm học 2020 - 2021 Đề 5, nội dung đề thi giúp đánh giá đúng năng lực học tập cũng như có thể cũng cố giúp các bạn ôn luyện. Để có kết quả cao hơn trong học tập, VnDoc xin giới thiệu tới các bạn học sinh tài liệu Chuyên đề Toán 8, Chuyên đề Vật Lý 8, Chuyên đề Hóa 8, Tài liệu học tập lớp 8 mà VnDoc tổng hợp và đăng tải.
Ngoài ra, VnDoc.com đã thành lập group chia sẻ tài liệu học tập THCS miễn phí trên Facebook: Tài liệu học tập lớp 8. Mời các bạn học sinh tham gia nhóm, để có thể nhận được những tài liệu mới nhất.




