Dung dịch FeSO4 và dung dịch CuSO4 đều tác dụng được với
Dãy điện hóa của kim loại
Dung dịch FeSO4 và dung dịch CuSO4 đều tác dụng được với được VnDoc biên soạn hướng dẫn bạn đọc dựa vào dãy điện hóa của kim loại để xác định cặp oxi hóa khử của kim loại.
Dung dịch FeSO4 và dung dịch CuSO4 đều tác dụng được với
A. Ag
B. Cu
C. Fe
D. Zn
Đáp án hướng dẫn giải chi tiết
Ta có cặp oxi hóa khử sắp xếp như sau: Zn2+/ Zn; Fe2+/ Fe; Cu2+/ Cu do vậy Fe2+ và Cu2+ có tính oxi hóa mạnh hơn Zn2+ nên có thể oxi hóa Zn thành Zn2+.
Zn + Fe2+ → Fe + Zn2+
Zn + Cu2+ → Cu + Zn2+
Đáp án D
Ý nghĩa dãy điện hóa của kim loại
Dãy điện hóa của kim loại là dãy những cặp oxi hóa khử của kim loại được được sắp xếp theo chiều tăng dần tính oxi hóa của ion kim loại và giảm dần tính khử của kim
Các kim loại đứng phía trước sẽ có tính khử mạnh hơn kim loại đứng sau. Ngược lại, các kim loại đứng sau sẽ có tính oxi hóa mạnh hơn những kim loại đứng trước.
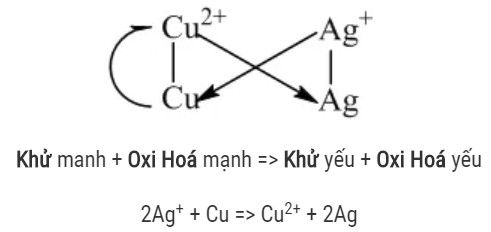
Ví dụ: Ag2++ Cu → Cu2++ Ag (kết tủa)
Quy tắc α cũng có những trường hợp ngoại lệ.
Thí dụ:
Các kim loại kiềm đầu dãy sẽ không khử kim loại. Mà ngược lại, chúng sẽ khử nước.
2K + 2H2O → 2KOH + H2
Các kim loại từ Mg đến trước Hidro, khi tác dụng với dung dịch axit sẽ tạo ra muối và giải phóng khí hidro.
Thí dụ:
Fe + 2HCl → FeCl2 + H2
Al, Fe, Cr sẽ thụ động với HNO3 đặc nguội và H2SO4 đặc nguội.
Các kim loại cuối dãy (Au, Pt,…) ko tác dụng được với axit.
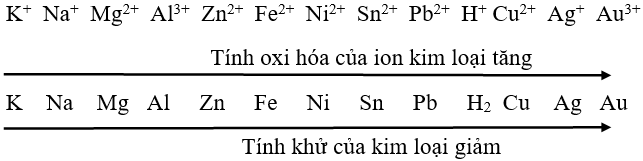
Dãy điện hóa của kim loại đầy đủ cho biết tính oxi hóa và tính khử của các chất
Xác định chiều của phản ứng oxi hóa – khử
Quy tắc α
Để viết đúng chiều của phản ứng oxi hóa – khử, người ta viết cặp oxi hóa – khử có thế điện cực chuẩn nhỏ ở bên trái, cặp oxi hóa – khử có thế điện cực chuẩn lớn hơn ở bên phải rồi viết phương trình theo quy tắc α
Xác định suất điện động chuẩn của pin điện hóa
Eopin = Eo (+) – Eo (−)
Câu hỏi vận dụng liên quan
Câu 1. Các hỗn hợp chất nào sau đây không cùng tồn tại trong cùng một dung dịch?
A. Ni(NO3)2 và AgNO3
B. Fe(NO3)2 và AgNO3
C. Fe(NO3)2 và Cu(NO3)2
D. Hg(NO3)2 và Cu(NO3)2
Câu 2. Cho bột Fe vào dung dịch AgNO3 dư, sau khi kết thúc thí nghiệm thu được dung dịch X gồm:
A. Fe(NO3)2, H2O
B. Fe(NO3)2, AgNO3
C. Fe(NO3)3, AgNO3
D. Fe(NO3)2, Fe(NO3)3, AgNO3
Phương trình phản ứng hóa học
2AgNO3 + Fe → 2Ag + Fe(NO3)2
AgNO3 + Fe(NO3)2 → Ag + Fe(NO3)3
Câu 3. Cho hỗn hợp gồm Fe và Mg vào dung dịch AgNO3, khi các phản ứng xảy ra hoàn toàn thu được dung dịch X (gồm hai muối) và chất rắn Y (gồm hai kim loại). Hai muối trong X là
A. Mg(NO3)2 và Fe(NO3)2.
B. Fe(NO3)3 và Mg(NO3)2.
C. AgNO3 và Mg(NO3)2.
D. Fe(NO3)2 và AgNO3.
Chất rắn Y gồm hai kim loại có tính khử yếu nhất là: Ag, Fe
Dung dịch X gồm hai muối của kim loại có tính khử mạnh nhất, mà Fe dư
→ Hai muối trong X là Mg(NO3)2 và Fe(NO3)2.
Mg + 2Ag+ → Mg2+ + 2Ag↓
Fe + 2Ag+ → Fe2+ + 2Ag ↓
Câu 4. X là kim loại phản ứng được với dung dịch H2SO4 loãng, Y là kim loại tác dụng được với dung dịch Fe(NO3)3. Hai kim loại X, Y lần lượt là (biết thứ tự trong dãy thế điện hoá: Fe3+/Fe2+ đứng trước Ag+/Ag
A. Fe, Cu.
B. Cu, Fe.
C. Ag, Mg.
D. Mg, Ag.
X phản ứng được với dung dịch H2SO4 → X đứng trước H trong dãy điện hóa → Loại đáp án B vì có Cu, loại C vì có Ag
Y tác dụng được với Fe3+ → Loại đáp án D
Đáp án A: X là Fe, Y là Cu
Fe + H2SO4 loãng → FeSO4 + H2↑
Cu + 2Fe(NO3)3 → 2Fe(NO3)2 + Cu(NO3)2
Câu 5. Cho khí CO (dư) đi vào ống sứ nung nóng đựng hỗn hợp X gồm Al2O3, MgO, Fe3O4, CuO thu được chất rắn Y. Cho Y vào dung dịch NaOH (dư), khuấy kĩ, thấy còn lại phần không tan Z. Giả sử các phản ứng xảy ra hoàn toàn. Phần không tan Z gồm
A. MgO, Fe, Cu.
B. Mg, Fe, Cu.
C. MgO, Fe3O4, Cu.
D. Mg, Al, Fe, Cu.
CO khử được các oxit của kim loại đứng sau Al trong dãy hoạt động hoá học.
CO + Al2O3 → không phản ứng
CO + MgO → không phản ứng
4CO + Fe3O4 → 3Fe + 4CO2
CO + CuO → Cu + CO2
→ Hỗn hợp Y: Al2O3, MgO, Cu, Fe
Al2O3 + 2NaOH → 2NaAlO2 + H2O
→ Hỗn hợp Z: MgO, Fe, Cu
Câu 6. X là kim loại phản ứng được với dung dịch H2SO4 loãng, Y là kim loại tác dụng được với dung dịch Fe(NO3)3. Hai kim loại X, Y lần lượt là (biết thứ tự trong dãy thế điện hoá: Fe3+/Fe2+ đứng trước Ag+/Ag.
A. Fe, Cu.
B. Cu, Fe.
C. Ag, Mg.
D. Mg, Ag.
X phản ứng được với dung dịch H2SO4 → X đứng trước H trong dãy điện hóa → Loại đáp án B vì có Cu, loại C vì có Ag
Y tác dụng được với Fe3+ → Loại đáp án D
Đáp án A: X là Fe, Y là Cu
Fe + H2SO4 loãng → FeSO4 + H2↑
Cu + 2Fe(NO3)3 → 2Fe(NO3)2 + Cu(NO3)2
Câu 7. Cho luồng khí H2 dư qua hỗn hợp các oxit CuO, Fe2O3, ZnO, MgO nung nóng ở nhiệt độ cao. Sau phản ứng, hỗn hợp chất rắn còn lại là
A. Cu, Fe, ZnO, MgO.
B. Cu, Fe, Zn, Mg.
C. Cu, Fe, Zn, MgO.
D. Cu, FeO, ZnO, MgO.
CuO, Fe2O3, ZnO bị bởi khử C, CO, H2 tạo thành Cu, Fe, Zn.
Còn lại MgO.
=> Hỗn hợp chất rắn thu được là Cu, Fe, Zn, MgO.
Câu 8. Cho hỗn hợp kim loại Mg, Zn, Fe vào dung dịch chứa AgNO3 và Cu(NO3)2. Sau khi phản ứng xảy ra hoàn toàn thu được dung dịch X gồm 3 muối và chất rắn Y gồm 3 kim loại. Ba muối trong X là
A. Mg(NO3)2, Fe(NO3)3, AgNO3.
B. Mg(NO3)2, Zn(NO3)2, Cu(NO3)2.
C. Mg(NO3)2, Zn(NO3)2, Fe(NO3)3.
D. Mg(NO3)2, Zn(NO3)2, Fe(NO3)2.
Dãy điện hóa : Mg2+/Mg Zn2+/Zn Fe2+/Fe Cu2+/Cu Ag+/Ag
→ Dung dịch X gồm 3 muối (ion có tính oxi hóa yếu nhất) là Mg(NO3)2, Zn(NO3)2 và Fe(NO3)2
............................................
Để tham khảo chi tiết đầy đủ nội dung dãy điện hóa của kim loại, mời các bạn ấn vào link:
>> Mời các bạn tham khảo thêm một số câu hỏi liên quan:




