Liên kết ion là gì?
Liên kết ion tinh thể ion
Liên kết ion là gì? được VnDoc biên soạn chi tiết đầy đủ nội dung lý thuyết kèm theo các dạng bài tập, ví dụ liên kết ion, để giúp các bạn học sinh nắm chắc được nội dung lý thuyết liên kết ion, sự hình thành liên kết ion từ đó có thể vận dụng vào giải các dạng bài tập tương tự. Mời các bạn tham khảo.
Liên kết ion là liên kết được hình thành bởi lực hút tĩnh điện giữa các ion mang điện tích trái dấu.
I. Sự hình thành ion, cation, anion
1. Nguyên tửu trung hòa về điện, khi nguyên tử nhường hay nhận electron nó trở thành phân tử mang điện gọi là ion
2. Các nguyên tử kim loại dễ nhường 1,2,3 electron ở lớp ngoài cùng để trở thành các ion mang 1,2,3 đơn vị điện tích dương, gọi là cation.
M → Mn+ + ne
Thí dụ: Các nguyên tử kim loại. Lớp ngoài cùng có 1, 2, 3 electron đều dễ dường electron để trở thành ion dương.
Na → Na+ + e
Ba → Ba2+ + 2e
Tên gọi: cation + tên kim loại.
Thí dụ: K+ gọi là cation kali.
3. Các nguyên tử phi kim dễ nhận thêm 1,2,3 electron để lớp ngoài cùng đạt đến cấu hình bền của khí trơ tương ứng trở thành các ion mang 1,2,3 đơn vị điện tích âm, gọi là anion.
X + ne → Xn-
Thí dụ:
Cl + 1e → Cl-
O + 2e → O2-
Tên goi: anion + tên gốc axit (trừ O2 gọi là anion oxit).
Thí dụ: F- gọi là anion florua.
II. Ion đơn nguyên tử và ion đa nguyên tử
1. Ion đơn nguyên tử là các ion tạo nên từ một nguyên tử.
Thí dụ: cation Li+, K+, Ba2+, Al3+ và anion F-, S2-.
2. Ion đa nguyên tử là những nhóm nguyên tử mang điện tích dương hay âm.
Thí dụ: cation amoni (NH4+), anion hiđroxit OH-, anion sunfat (SO42-)
III. Sự tạo thành liên kết ion
Liên kết ion là liên kết được hình thành bởi lực hút tĩnh điện giữa các ion mang điện tích trái dấu.
Liên kết ion dược hình thành giữa kim loại điển hình và phi kim điển hình.
Thí dụ:
Xét sự hình thành liên kết ion trong phân tử NaCl
Nguyên tử Na (1s22s22p63s1) nhường 1 electron cho nguyên tử Cl (1s22s22p6), đồng thời nguyên tử clo nhận 1 electron của nguyên tử Na để biến đổi thành anion Cl- (1s22s22p63s23p6), có thể biểu diễn quá trình trên như sau:
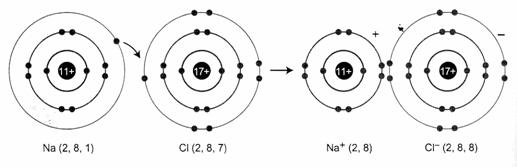
Na + Cl → Na+ + Cl-
Hai ion được tạo thành mang điện tích ngược dấu hút nhau bằng lực hút tĩnh điện, tạo nên phân tử NaCl:
Na+ + Cl- → NaCl
Liên kết giữa cation Na+ và anion Cl- là liên kết ion.
Phản ứng hoá học trên có thể được biểu diễn bằng phương trình hoá học sau:
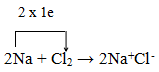
IV. Tinh thể ion
1. Tinh thể NaCl
Ở thể rắn, NaCl tồn tại dưới dựng tinh thể ion. Trong mạng tinh thể NaCl các ion Na+ và Cl- được phân bố luân phiên đều đặn trên các đỉnh của các hình lập phương nhỏ.
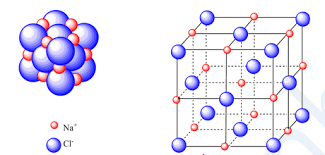
Mô hình tinh thể NaCl, natri clorua
2. Tinh chất chung của hợp chất ion
Tinh thể ion rất bền vững, khá rắn, khó nóng chảy và khó bay hơi. Vì lực hút tính điện giữa các ion ngược dấu trong tinh thể ion rất lớn.
V. Bài tập vận dụng liên kết ion
Câu 1. Hợp chất trong phân tử có liên kết ion là
A. H2SO4
B. NH3
C. H2O
D. NH4Cl
Câu 2. Dãy chất nào sau đây chỉ có liên kết ion
A. NaCl, H2O, KCl, CsF
B. CH4, SO2, NaCl, KCl
C. KCl, NaCl, NH3, HCl
D. NaCl, CsF, KF, KCl
Câu 3. Liên kết ion là liên kết được hình thành bời lực hút tĩnh điện giữa các
A. Anion và electron tự do
B. Các ion mang điện tích cùng dấu
C. Hạt nhân của nguyên tử này và hạt nhân của nguyên tử kia
D. Cation và anion
Câu 4. Nhóm hợp chất nào sau đây đều là hợp chất ion?
A. H2S, K2O.
B. CH4, CO2.
C. CaO, KCl.
D. SO2, NaCl.
Câu 5. Điện hóa trị của Ba và Cl trong BaCl2 theo thứ tự là:
A. 2 và 1.
B. 2+ và 1–.
C. +2 và –1.
D. 2+ và 2–
...................



