Đề thi Hóa học kì 2 lớp 8 năm 2023 - Đề nâng cao số 3
Đề thi hóa lớp 8 học kì 2 có đáp án - Đề nâng cao số 3
Bên cạnh các đề thi học kì 2 Hóa 8 cơ bản, VnDoc gửi tới các bạn đề thi học kì 2 nâng cao Hóa 8 cho các em ôn luyện. Đề thi Hóa học kì 2 lớp 8 - Đề nâng cao số 3 do đội ngũ giáo viên của VnDoc biên soạn các câu hỏi lý thuyết, bài tập Nâng cao lớp 8 học kì 2. Là tài liệu hữu ích giúp các em củng cố, luyện tập làm các dạng bài tập nâng cao trong Hóa học 8, để chuẩn bị tốt cho kì thi sắp tới.
ĐỀ THI CUỐI HỌC KÌ II MÔN HÓA HỌC NÂNG CAO LỚP 8
Bản quyền thuộc về VnDoc nghiêm cấm mọi hành vi sao chép vì mục đích thương mại
Đề số 3
Phần 1. Trắc nghiệm (3 điểm)
Câu 1. Thao tác thí nghiệm nào sau đây đúng và an toàn nhất?
A. Đốt khí hidro vừa điều chế
B. Thử độ tinh khiết của hidro trước khi đốt
C. Chờ khí hidro thoát ra khỏi một thời gian mới đốt
D. Đốt khí hidro khi nào cũng được
Câu 2. Oxit nào là oxit axit trong số các oxit kim loại cho dưới đây?
A. Li2O
B. MgO
C. CrO3
D.Cr2O3
Câu 3. Khi thổi không khí vào nước nguyên chất, dung dịch thu được hơi có tính axit. Khí nào sau đây gây nên tính axit đó?
A. CO2
B. H2
C. N2
D. O2
Câu 4. Hợp chất nào sau đây là bazơ?
A. Đồng (II) nitrat
B. Kali clorua
C. Sắt (III) sunfat
D. Canxi hidroxit
Câu 5. Công thức nào sau đây biểu diễn đúng mối quan hệ C% và CM
A. ![]() \(C\% = \frac{{{m_{ct}}}}{{V \times {m_{dd}}}} \times 100\%\)
\(C\% = \frac{{{m_{ct}}}}{{V \times {m_{dd}}}} \times 100\%\)
B. ![]() \(C\% = \frac{{{m_{ct}}}}{{D \times {m_{dd}}}} \times 100\%\)
\(C\% = \frac{{{m_{ct}}}}{{D \times {m_{dd}}}} \times 100\%\)
C. ![]() \(C\% = \frac{{{m_{ct}}}}{{V \times D}} \times 100\%\)
\(C\% = \frac{{{m_{ct}}}}{{V \times D}} \times 100\%\)
D. ![]() \(C\% = \frac{{{m_{dd}}}}{{V \times D}} \times 100\%\)
\(C\% = \frac{{{m_{dd}}}}{{V \times D}} \times 100\%\)
Câu 6. Khi giảm nhiệt độ thì độ tan của chất rắn trong nước thay đổi như thé nào?
A. Đều tăng
B. Đều giảm
C. Phần lớn tăng
D. Phần lớn giảm
Câu 7. Ở 20oC, 300g nước hòa tan tối đa 264g muối kali nitrat (KNO3). Độ tan của muối này là:
A. 44 gam
B. 50 gam
C. 88 gam
D. 100 gam
Câu 8. Dùng tính tan hãy lựa chọn câu trả lời đúng trong các câu sau:
Dãy các chất tan được trong nước
A. KOH, CuSO4, H2SO4, MgSO4
B. NaCl, MgCl2, Ba(NO3)2, Fe(OH)3
C. NaOH, HNO3, BaCO3, Al(OH)3
D. FeCl3, KNO3, HCl, Na2CO3
Câu 9. Phản ứng nào sau đây là phản ứng thế
A. 4P + 5O2 ![]() \(\overset{t^{\circ } }{\rightarrow}\) P2O5
\(\overset{t^{\circ } }{\rightarrow}\) P2O5
B. CaO + H2O → Ca(OH)2
C. 2KClO3 ![]() \(\overset{t^{\circ } }{\rightarrow}\) 2KCl + 3O2
\(\overset{t^{\circ } }{\rightarrow}\) 2KCl + 3O2
D. Mg + 2HCl → MgCl2 + H2
Câu 10. Cặp chất nào sau đây khi tan trong nước chúng tác dụng với nhau tạo ra chất khí bay ra?
A. BaCl2 và H2SO4
B. NaCl và Na2SO3
C. HCl và Na2CO3
D. AlCl3 và H2SO4
Phần 2. Tự luận (7 điểm )
Câu 1 (2 điểm) Hoàn thành chuỗi phản ứng hóa học sau
KMnO4 → O2 → SO2 → SO3 → H2SO4 → Na2SO4
Câu 2. (1.5điểm)
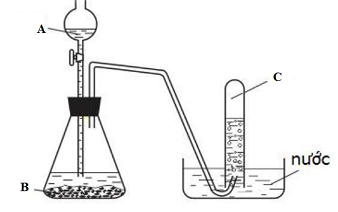
- Hình vẽ trên mô tả thí nghiệm nào đã được học?
- Cho biết tên gọi và công thức hóa học lần lượt các chất A,B,C
- Viết phương trình hóa học của thí nghiệm trên
Câu 3. (2,5 điểm) Khử 50 gam hỗn hợp đồng (II) oxit và sắt (III) oxit bằng khí hidro. Biết trong hỗn đồng (II) oxit chiếm 20% về khối lượng. Hãy tính:
a) Thể tích khí hidro ở đktc?
b) Tính khối lượng bazo thu được sau phản ứng.
Câu 4. (1 điểm) Nung 2,45 gam một chất hóa học M thấy thoát ra 672ml khí O2 (đktc). Phần rắn còn lại chứa 52,35% Kali và 47,65% Clo (về khối lượng). Tìm công thức của chất hóa học M.
( Biết: Mg = 24, Zn = 65, Cl = 35.5 , H = 1; O = 16, Cu= 64, Fe = 56)
Đáp án đề kiểm thi cuối kì 2 môn Hóa học nâng cao lớp 8
Phần 1. Trắc nghiệm (3 điểm)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| B | C | A | D | C | D | C | D | D | C |
Phần 2. Tự luận (7 điểm)
Câu 1.
(1) 2KMnO4 ![]() \(\overset{t^{\circ } }{\rightarrow}\) K2MnO4 + MnO2 + O2
\(\overset{t^{\circ } }{\rightarrow}\) K2MnO4 + MnO2 + O2
(2) O2 + S ![]() \(\overset{t^{\circ } }{\rightarrow}\) SO2
\(\overset{t^{\circ } }{\rightarrow}\) SO2
(3) 2SO2 + O2 ![]() \(\overset{t^{\circ } }{\rightarrow}\) 2SO3
\(\overset{t^{\circ } }{\rightarrow}\) 2SO3
(4) SO3 + H2O ![]() \(\overset{}{\rightarrow}\) H2SO4
\(\overset{}{\rightarrow}\) H2SO4
(5) H2SO4 + 2NaOH → Na2SO4 + 2H2O
Câu 2.
Hình vẽ trên mô tả thí nghiệm điều chế khí hidro trong phòng thí nghiệm.
Tên gọi và công thức hóa học lần lượt các chất:
A: HCl axit clohdric
B: Zn Kẽm
C: H2 hidro
Viết phương trình hóa học của thí nghiệm trên
Zn + 2HCl → ZnCl2 + H2
Câu 3.
Theo đề bài ta có:
 \(\begin{array}{l}
{m_{CuO}} = \frac{{50 \times 20}}{{100}} = 10 gam\\
= > {n_{CuO}} = \frac{{10}}{{80}} = 0,125 mol\\
{m_{F{e_2}{O_3}}} = 50 - 10 = 40 gam\\
= > {n_{F{e_2}{O_3}}} = \frac{{40}}{{160}} = 0,25 mol
\end{array}\)
\(\begin{array}{l}
{m_{CuO}} = \frac{{50 \times 20}}{{100}} = 10 gam\\
= > {n_{CuO}} = \frac{{10}}{{80}} = 0,125 mol\\
{m_{F{e_2}{O_3}}} = 50 - 10 = 40 gam\\
= > {n_{F{e_2}{O_3}}} = \frac{{40}}{{160}} = 0,25 mol
\end{array}\)
CuO + H2 ![]() \(\overset{t^{\circ } }{\rightarrow}\) H2O + Cu (1)
\(\overset{t^{\circ } }{\rightarrow}\) H2O + Cu (1)
0,125 mol → 0,125 mol
Fe2O3 + 3H2 ![]() \(\overset{t^{\circ } }{\rightarrow}\) 3H2O + 2Fe (2)
\(\overset{t^{\circ } }{\rightarrow}\) 3H2O + 2Fe (2)
0,25 mol → 0,75 mol
Tổng số mol H2 có ở phương trình (1), (2) là: 0,125 + 0,75 = 0,875 mol
Thể tích khí là: 0,875 x 22,4 = 19,6 lít
b) Dựa vào phương trình (1), (2)
![]() \(\begin{array}{l}
{m_{Cu}} = 0,125 \times 64 = 8 gam\\
{m_{Fe}} = 0,25 \times 2 \times 56 = 28 gam
\end{array}\)
\(\begin{array}{l}
{m_{Cu}} = 0,125 \times 64 = 8 gam\\
{m_{Fe}} = 0,25 \times 2 \times 56 = 28 gam
\end{array}\)
Câu 4.
Gọi công thức hóa học cần tìm là KxOyClz
 \(\begin{array}{l}
{n_{{O_2}}} = \frac{{0,672}}{{22,4}} = 0,03 mol = > {n_{{O_{}}}} = 0,06mol\\
{m_O} = 0,06 \times 16 = 0,96gam
\end{array}\)
\(\begin{array}{l}
{n_{{O_2}}} = \frac{{0,672}}{{22,4}} = 0,03 mol = > {n_{{O_{}}}} = 0,06mol\\
{m_O} = 0,06 \times 16 = 0,96gam
\end{array}\)
Ta có:
mA = mO + mK + mCl => mK + mCl = 2,45 - 0,96 = 1,49 gam
Theo đề bài ta có:
 \(\begin{array}{l}
{m_K} = 1,49 \times \frac{{52,35}}{{100}} = 0,78gam = > {m_K} = 0,02mol\\
{m_{Cl}} = 1,49 - 0,78 = 0,71gam = > {m_{Cl}} = 0,02mol
\end{array}\)
\(\begin{array}{l}
{m_K} = 1,49 \times \frac{{52,35}}{{100}} = 0,78gam = > {m_K} = 0,02mol\\
{m_{Cl}} = 1,49 - 0,78 = 0,71gam = > {m_{Cl}} = 0,02mol
\end{array}\)
nK: nO : nCl = x : y : z = 0,02 : 0,02 : 0,06 = 1 : 1 : 3
Vậy công thức phân tử M: KClO3
Đề thi Hóa học kì 2 lớp 8 - Đề nâng cao số 3 được giáo viên VnDoc biên soạn kèm đáp án đề thi gồm 10 câu hỏi trắc nghiệm lí thuyết, 4 câu hỏi tự luận là các dạng bài tập nâng cao trong chương trình Hóa học 8. Đòi hỏi các em phải nắm chắc kiến thức vận dụng cao để giải quyết các câu hỏi trong đề thi hóa lớp 8 học kì 2.
Để mang đến cho các em học sinh nguồn tài liệu ôn thi học kì 2 lớp 8 môn Hóa, bên cạnh các đề thi học kì 2 cơ bản, VnDoc biên soạn những đề thi nâng cao dành cho các bạn học sinh có học lực khá giỏi để thử sức và ôn luyện, đây cũng là tài liệu hay cho các bạn học sinh lớp chuyên ôn thi môn Hóa hiệu quả hơn. Để có thêm các đề ôn thi khác, mời các em vào chuyên mục Đề thi học kì 2 lớp 8 và Đề thi học kì 2 lớp 8 môn Hóa trên VnDoc để ôn luyện nhé.
Ngoài ra, VnDoc.com đã thành lập group chia sẻ tài liệu học tập THCS miễn phí trên Facebook, mời bạn tham gia nhóm Tài liệu học tập lớp 8 để có thể cập nhật được tài liệu sớm nhất.




