Điều chế Oxi trong phòng thí nghiệm
Cách điều chế oxi trong phòng thí nghiệm
Điều chế Oxi trong phòng thí nghiệm được VnDoc biên soạn hướng dẫn bạn đọc trả lời câu hỏi liên quan đến điều chế O2 trong phòng thí nghiệm. Cũng như đưa ra các nội dung câu hỏi, lý thuyết liên quan đến phương pháp điều chế oxi trong phòng thí nghiệm. Mời các bạn tham khảo chi tiết nội dung dưới đây.
1. Điều chế oxi trong phòng thí nghiệm
Phương pháp chung để điều chế khí oxi trong phòng thí nghiệm là nhiệt phân các hợp chất giàu oxi, dễ bị phân hủy ở nhiệt độ cao như Kali pemanganat (KMnO4) và Kali clorat (KClO3).
Trong phòng thí nghiệm, người ta điều chế khí oxi bằng cách đun nóng những hợp chất giàu oxi như: KClO3, KMnO4 ,…. và dễ phân hủy ở nhiệt độ cao.
2. Nguyên liệu điều chế oxi trong phòng thí nghiệm
Trong phòng thí nghiệm, người ta điều chế khí oxi bằng cách đun nóng những hợp chất giàu oxi như: KClO3, KMnO4 ,…. và dễ phân hủy ở nhiệt độ cao
3. Điều chế oxi từ KMnO4
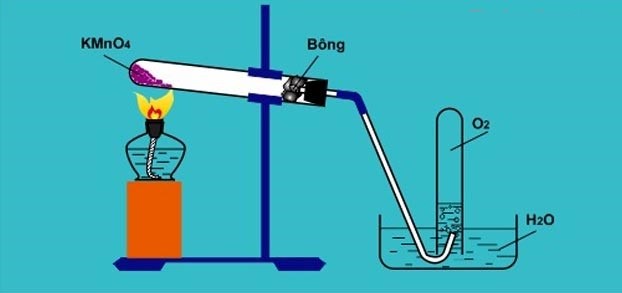
Oxi là khí duy trì sự sống và sự cháy nên tàn đóm bùng cháy.
Phương trình hóa học:
2KMnO4 ![]() \(\overset{t^{o} }{\rightarrow}\)K2MnO4 + MnO2 + O2
\(\overset{t^{o} }{\rightarrow}\)K2MnO4 + MnO2 + O2
Tương tự nếu đun nóng Kali clorat (KClO3) trong ống nghiệm cũng có khí oxi thoát theo phương trình:
2KClO3 ![]() \(\overset{t^{o}, xt MnO_{2} }{\rightarrow}\)2KCl + 3O2 ↑
\(\overset{t^{o}, xt MnO_{2} }{\rightarrow}\)2KCl + 3O2 ↑
Nếu thêm bột mangan(IV) oxit vào KClO3 rồi mới đem đi nhiệt phân thì phản ứng xảy ra nhanh hơn. MnO2 là chất xúc tác.
4. Cách thu khí oxi trong phòng thí nghiệm
Có 2 phương pháp thu khí oxi trong phòng thí nghiệm:
+ Bằng cách đẩy không khí (vì khí oxi nặng hơn không khí).
+ Bằng cách đẩy nước (vì khí oxi ít tan trong nước)
5. Câu hỏi vận dụng liên quan điều chế khí Oxi trong phòng thí nghiệm
Câu 1. Khí nào sau đây có thể thu được bằng phương pháp dời chỗ nước?
A. O2
B. HCl
C. H2S
D. SO2
Câu 2. Người ta thu khí oxi bằng cách đẩy không khí là dựa vào tính chất nào?
A. Oxi tan trong nước
B. Oxi nặng hơn không khí
C. Oxi không mùi, màu, vị
D. Khí oxi dễ trộn lẫn trong không khí
Câu 3. Trong phòng thí nghiệm, người ta điều chế oxi bằng cách
A. Điện phân nước.
B. Nhiệt phân Cu(NO3)2.
C. Nhiệt phân KClO3 có xúc tác MnO2
D. Chưng cất phân đoạn không khí lỏng.
Câu 4. Nguyên liệu điều chế oxi trong phòng thí nghiệm là
A. H2O
B. KMnO4
C. Cu(NO3)2
D. Không khí
Câu 5. Trong phòng thí nghiệm để điều chế O2 người ta có thể sử dụng cách nào sau đây?
A. Chưng cất phân đoạn không khí lỏng.
B. Điện phân dung dịch ZnSO4.
C. Nhiệt phân các chất giàu oxi và kém bền nhiệt, ví dụ như KMnO4, KClO3
D. Điện phân nước có hòa tan một lượng nhỏ H2SO4 hoặc NaOH.
Trong phòng thí nghiệm, người ta điều chế khí oxi bằng cách đun nóng những hợp chất giàu oxi như: KClO3, KMnO4,…. và dễ phân hủy ở nhiệt độ cao
Câu 6. Khi thu khí O2 trong phòng thí nghiệm, có thể thu theo cách nào sau đây để có thể biết được khi nào bình đã đầy O2?
A. Đẩy nước và úp bình
B. Đẩy không khí và úp bình
C. Đẩy không khí và ngửa bình
D. Đẩy nước và ngửa bình
Có 2 phương pháp thu khí oxi trong phòng thí nghiệm:
+ Bằng cách đẩy không khí (vì khí oxi nặng hơn không khí).
+ Bằng cách đẩy nước (vì khí oxi ít tan trong nước)
Câu 7. Trong các phản ứng sau, phản ứng nào thường dùng để điều chế O2 trong công nghiệp?
A. 2KMnO4 ![]() \(\overset{t^{o} }{\rightarrow}\) K2MnO4 + MnO2 + O2
\(\overset{t^{o} }{\rightarrow}\) K2MnO4 + MnO2 + O2
B. 6CO2 + 6H2O ![]() \(\overset{t^{o} }{\rightarrow}\) C6H12O6 + 6O2(diệp lục)
\(\overset{t^{o} }{\rightarrow}\) C6H12O6 + 6O2(diệp lục)
C. 2H2O ![]() \(\overset{t^{o} }{\rightarrow}\) 2H2 + O2
\(\overset{t^{o} }{\rightarrow}\) 2H2 + O2
D. 2H2O2 ![]() \(\overset{t^{o} }{\rightarrow}\) O2 + 2H2O
\(\overset{t^{o} }{\rightarrow}\) O2 + 2H2O
Câu 8. Phát biểu nào sau đây không đúng?
A. Dùng KMnO4 oxi hoá dung dịch HCl đặc tạo ra khí Cl2.
B. Nhiệt phân KMnO4 tạo ra khí O2.
C. Cho dung dịch HCl dư vào CuS tạo ra khí H2S.
D. Cho dung dịch HCl dư vào dung dịch Na2SO3 tạo ra khí SO2
CuS không tan trong dung dịch axit
Nội dung C sai
Câu 9. Trong phòng thí nghiệm người ta điều chế oxi bằng cách nhiệt phân KClO3 hay KMnO4 hoặc KNO3. Vì lí do nào sau đây?
A. Nguyên liệudễ kiếm, giá thành rẻ tiền
B. Hợp chất giàu oxi và dễ phân hủy ra oxi
C. Phù hợp với các trang thiết bị, máy móc
D. Không độc hại, ảnh hưởng đến sức khỏe, môi trường
Trong phòng thí nghiệm người ta điều chế oxi bằng cách nhiệt phân KClO3 hay KMnO4 hoặc KNO3. Vì lí hợp chất giàu oxi và dễ phân hủy ra oxi
------------------------------------------
Trên đây VnDoc đã gửi tới bạn đọc chi tiết nội dung Điều chế Oxi trong phòng thí nghiệm. Hy vọng tài liệu sẽ giúp ích cho bạn đọc nắm vững kiến thức được học, đồng thời vận dụng làm các câu hỏi liên quan đến điều chế O2 trong phòng thí nghiệm một cách dễ dàng hơn.
Để có kết quả cao hơn trong học tập, VnDoc xin giới thiệu tới các bạn học sinh tài liệu Hóa học 8, Giải bài tập Hóa học 8, Giải SBT Hóa 8 mà VnDoc tổng hợp và đăng tải.
Ngoài ra, VnDoc.com đã thành lập group chia sẻ tài liệu học tập THCS miễn phí trên Facebook: Tài liệu học tập lớp 8. Mời các bạn học sinh tham gia nhóm, để có thể nhận được những tài liệu mới nhất.





