Bộ 10 đề thi Hóa học kì 2 lớp 8 năm 2021 Có đáp án
Bộ 10 đề thi Hóa học kì 2 lớp 8 năm 2021 được đội ngũ giáo viên VnDoc biên soạn là đề thi Hóa học kì 2 lớp 8 có đáp án, thang điểm chi tiết kèm theo. Cấu trúc nội dung đề thi học kì 2 bám sát khung chương trình Hóa học 8, đảm bảo đánh giá đúng năng lực kiểm tra, cũng như giúp các em rèn luyện kỹ năng làm đề nhanh và chính xác hơn.
Đề thi Hóa học kì 2 lớp 8 năm 2021 có đáp án
- Đề thi Hóa học kì 2 lớp 8 - Đề 1
- Đáp án đề kiểm tra môn Hóa học kì II lớp 8 - Đề số 1
- Đề thi Hóa học kì 2 lớp 8 - Đề 2
- Đáp án đề kiểm tra môn Hóa học kì II lớp 8 - Đề số 2
- Đề thi Hóa học kì 2 lớp 8 - Đề 3
- Đáp án đề kiểm thi cuối kì 2 môn Hóa học lớp 8 - Đề số 3
- Đề thi Hóa học kì 2 lớp 8 - Đề 4
- Đáp án đề kiểm tra học kì 2 môn Hóa học 8 - Đề số 4
Đề thi Hóa học kì 2 lớp 8 - Đề 1
Phần 1: Trắc nghiệm (5 điểm)
Câu 1. Thành phần của không khí (theo thể tích):
A. 21% O2, 78% N2 và 1 % là hơi nước.
B. 21% O2, 78% N2 và 1 % là các khí khác.
C. 21% O2, 78% N2 và 1 % là khí CO2.
D. 20% O2, 80% N2.
Câu 2. Nhóm các chất nào sau đây đều là axit?
A. HCl, H3PO4, H2SO4, H2O.
B. HNO3, H2S, KNO3, CaCO3, HCl.
C. H2SO4, H3PO4, HCl, HNO3.
D. HCl, H2SO4, H2S, KNO3.
Câu 3. Cho dãy chất sau: CO2, P2O5, CaCO3, SO3, Na2O, SiO2, CO, ZnO, PbO, N2O5, NO. Những chất nào là oxit axit?
A. CO2, CaCO3, SO3, Na2O, SiO2.
B. CO2, ZnO, P2O5, SO3, SiO2, NO.
C. CO2, SO3, CO, N2O5, PbO .
D. CO2, SO3, SiO2, N2O5, P2O5.
Câu 4. Phản ứng hóa học nào dưới đây không phải là phản ứng thế?
A. CuO + H2 ![]() \(\overset{t^{\circ } }{\rightarrow}\) Cu + H2O
\(\overset{t^{\circ } }{\rightarrow}\) Cu + H2O
B. Mg + 2HCl → MgCl2+ H2
C. Ca(OH)2 + CO2 → CaCO3 + H2O
D. Zn + CuSO4 → Cu + ZnSO4
Câu 5. Tính số gam nước tạo ra khi đốt cháy hoàn toàn 4,48 lít khí hidro (đktc) trong oxi?
A. 3,6 g
B. 7,2 g
C. 1,8 g
D. 14,4g
Câu 6. Càng lên cao, tỉ lệ thể tích khí oxi càng giảm vì:
A. càng lên cao không khí càng loãng .
B. oxi là chất khí không màu không mùi.
C. oxi nặng hơn không khí.
D. oxi cần thiết cho sự sống.
Câu 7. Đốt cháy 6,2g photpho trong bình chứa 10g oxi. Sau phản ứng chất nào còn dư, vì sao?
A. Oxi vì 6,2g photpho phản ứng đủ với 4g oxi.
B. Oxi vì 6,2g photpho phản ứng đủ với 2g oxi.
C. Hai chất vừa hết vì 6,2g photpho phản ứng vừa đủ với 10g oxi.
D. Photpho vì ta thấy tỉ lệ số mol giữa đề bài và phương trình của photpho lớn hơn của oxi.
Câu 8. Bằng phương pháp hóa học nhận biết các chất sau: NaCl, axit H2SO4, KOH, Ca(OH)2, bằng cách nào?
A. Quỳ tím, điện phân.
B. Quỳ tím
C. Quỳ tím, sục khí CO2
D. Nước, sục khí CO2
Câu 9. Tính khối lượng NaOH có trong 200g dung dịch NaOH 15%.
A. 60 gam
B. 30 gam
C. 40 gam
D. 50 gam
Câu 10. Tính thể tích của dung dịch NaOH 5M để trong đó có hòa tan 60g NaOH.
A. 300 ml
B. 600 ml
C. 150 ml
D. 750 ml
Phần 2: Tự luận (5 điểm)
Câu 1. (2,5 điểm)
Cho 5,4 gam Al tác dụng với dung dịch HCl phản ứng xảy ra hoàn toàn. Dẫn toàn bộ lượng khí thu được qua CuO nung nóng.
a. Viết phương trình hóa học của phản ứng xảy ra. Tính khối lượng muối thu được sau phản ứng.
b. Tính khối lượng Cu thu được sau phản ứng?
Câu 2. (2,5 điểm)
Cho 6,5 gam Zn phản ứng vừa đủ với 100 ml dung dịch axit HCl.
a. Tính thể tích khí hidro thu được ở điều kiện tiêu chuẩn?
b. Tính nồng độ mol của dung dịch muối thu được sau phản ứng?
(Al = 27, Cu= 64, O = 16, H = 1, Cl = 35,5, Zn = 65, Na = 23, P = 31)
Đáp án đề kiểm tra môn Hóa học kì II lớp 8 - Đề số 1
Phần 1. Trắc nghiệm ( 5 điểm) 0,5 đ/1 câu
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| B | C | D | C | A | C | D | C | B | A |
Phần 2. Tự luận (5 điểm)
| Câu | Đáp án | Điểm |
|
Câu 1 (2,5 điểm) |
a. nAl = 0,2 mol 2Al + 6HCl → 2AlCl3 + 3H2 nAl= n AlCl3= 0,2 mol => m AlCl3 = 0,2 x(27 + 35,5 x 3) = 26,7 gam b. CuO + H2 n H2 = 0,3 mol => nCu= 0,3 mol mCu = 0,3 x 64 = 19,2 g |
0,25 0,25 0,75 0,25 0,5 0,5 |
|
Câu 2 (2,5 điểm) |
a. nZn = 0,1 mol Zn + 2HCl → ZnCl2 + H2 nZn= n H2 = 0,1 mol =>V H2= 0,1 x 22,4 = 2,24 lít b. n ZnCl2 = nH2 = 0,1 mol CM = n/V= 0,1/0,1= 1M |
0,25 0,5 0,75 0,25 0,75 |
Đề thi Hóa học kì 2 lớp 8 - Đề 2
Phần I. Trắc nghiệm (5 điểm)
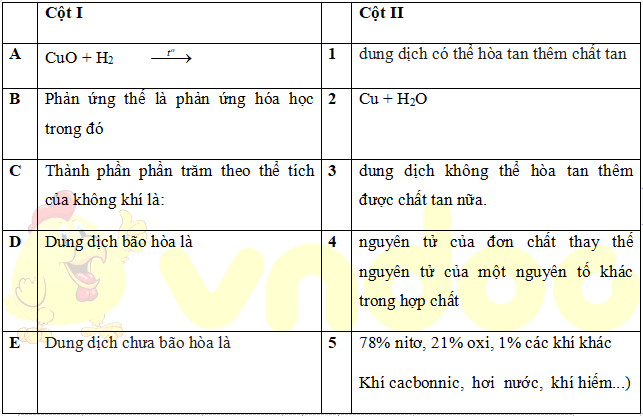
Câu 1. Ghép một trong các chữ A hoặc B, C, D ở cột I với một chữ số 1 hoặc 2, 3, 4, 5, ở cột II để có nội dung phù hợp.
Câu 2. Cho các chất sau: C, CO, CO2, S, SO2, SO3, FeO, Fe2O3, Fe, NaOH, MgCO3, HNO3. Dãy chất gồm các oxit?
A. CO, CO2, SO2, FeO, NaOH, HNO3.
B. CO2, S, SO2, SO3, Fe2O3, MgCO3.
C. CO2, SO2, SO3, FeO, Fe2O3, CO.
D. CO2, SO3, FeO, Fe2O3, NaOH, MgCO3.
Câu 3. Cho các phản ứng hóa học sau:
CaCO3 ![]() \(\overset{t^{\circ } }{\rightarrow}\) CaO + CO2 (1)
\(\overset{t^{\circ } }{\rightarrow}\) CaO + CO2 (1)
2KClO3 ![]() \(\overset{t^{\circ } }{\rightarrow}\) KCl + 3O2 (2)
\(\overset{t^{\circ } }{\rightarrow}\) KCl + 3O2 (2)
2KMnO4 ![]() \(\overset{t^{\circ } }{\rightarrow}\) K2MnO4 + MnO2 + O2 (3)
\(\overset{t^{\circ } }{\rightarrow}\) K2MnO4 + MnO2 + O2 (3)
Zn + CuSO4 → Cu + ZnSO4 (4)
2H2O ![]() \(\overset{t^{\circ } }{\rightarrow}\) H2 + 3O2 (5)
\(\overset{t^{\circ } }{\rightarrow}\) H2 + 3O2 (5)
Phản ứng phân hủy là:
A. 2; 3; 5; 4
C. 4; 1; 5; 3
B. 1; 2; 3; 5
D. 5; 1; 4; 3
Câu 4. Sau phản ứng với Zn và HCl trong phòng thí nghiệm, đưa que đóm đang cháy vào ống dẫn khí, khí thoát ra cháy được trong không khí với ngọn lửa màu gì?
A. Xanh nhạt.
B. Cam.
C. Đỏ cam.
D. Tím.
Câu 5. Tính khối lượng Kali penmanganat (KMnO4) cần lấy để điều chế được 3,36 lít khí oxi (đktc).
A. 71,1 g
B. 23,7 g
C. 47,4 g
D. 11,85 g
Câu 6. Có 3 oxit sau: MgO, Na2O, SO3. Có thể nhận biết được các chất đó bằng thuốc thử sau đây không:
A. Dùng nước và giấy quỳ tím.
B. Chỉ dùng nước
C. Chỉ dùng axit
D. Chỉ dùng dung dịch kiềm
Câu 7. Cho 13 gam kẽm tác dụng với 0,3 mol HCl. Sau phản ứng chất nào còn dư và dư bao nhiêu gam?
A. Zn dư; 6,5 gam.
B. HCl dư; 1,825 gam
C. HCl dư; 3,65 gam
D. Zn dư; 3,25 gam
Câu 8. Trong phòng thí nghiệm khí hidro được điều chế từ chất nào?
A. Điện phân nước
B. Từ thiên nhiên khí dầu mỏ
C. Cho Zn tác dụng với axit loãng (HCl, H2SO4,…)
D. Nhiệt phân KMnO4
Câu 9. Tên gọi của P2O5
A. Điphotpho trioxit
B. Điphotpho pentaoxit
C. Điphotpho oxit
D. Photpho trioxit
Câu 10. Ở 20oC, 60 gam KNO3 tan trong 190 gam nước thì thu được dung dịch bão hòa. Tính độ tan của KNO3 ở tại nhiệt độ đó?
A. 32,58 g
B. 3,17 g
C. 31,55 g
D. 31,58 g
Phần II: Tự luận (5 điểm)
Câu 1. (2,5 điểm)
(1) C2H4 + O2 ![]() \(\overset{t^{\circ } }{\rightarrow}\)…………………….
\(\overset{t^{\circ } }{\rightarrow}\)…………………….
(2)………………… → AlCl3
(3)……………………… ![]() \(\overset{t^{\circ } }{\rightarrow}\) CuO
\(\overset{t^{\circ } }{\rightarrow}\) CuO
(4) H2O ![]() \(\overset{t^{\circ } }{\rightarrow}\) ……………………..
\(\overset{t^{\circ } }{\rightarrow}\) ……………………..
(5) .………………….. → H3PO4
(6) Fe + H2SO4 → ………………..
Câu 2. (2,5 điểm)
Hòa tan hoàn toàn 19,5 gam Zn phản ứng vừa đủ với 150 dung dịch axit H2SO4. Dẫn toàn bộ khí hidro vừa thoát ra vào sắt (III) oxit dư, thu được m gam sắt.
a. Viết phương trình hóa học xảy ra?
b. Tính nồng độ phần trăm của dung dịch axit H2SO4 đã dùng?
c. Tính m.
(Al = 27, Cu = 64, O = 16, H = 1, Cl = 35,5, Zn = 65, Na = 23, N = 14, S = 32)
Đáp án đề kiểm tra môn Hóa học kì II lớp 8 - Đề số 2
Phần 1. Trắc nghiệm (5 điểm)
Câu 1: 1,5 điểm
| A-2 | B- 4 | C- 5 | D- 3 | E- 1 |
| 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| C | B | A | C | A | D | C | B | D |
Phần 2. Tự luận (5 điểm)
| Câu | Đáp án | Điểm |
|
Câu 1 (2,5 điểm)
|
(1) C2H4 + 3O2 (2) 2Al + 3Cl2 → 2AlCl3 (3) 2Cu + O2 (4) 2H2O (5) P2O5 + 3H2O → 2H3PO4 (6) Fe + H2SO4 → FeSO4 + H2 |
0,5 0,5 0,5 0,5 0,25 0,25 |
| Câu 2. (2,5 điểm) |
a) n = 0,3 mol Zn + H2SO4 → ZnSO4 + H2
b) Fe2O3 + 3H2
|
0,25 0,25 0,5 0,75
0,25 |
| Tổng | 5 điểm |
Đề thi Hóa học kì 2 lớp 8 - Đề 3
Phần 1. Trắc nghiệm (3 điểm)
Câu 1. Phát biểu nào sau đây về oxi là không đúng?
A. Oxi là phi kim hoạt động hoá học rất mạnh.
B. Oxi tạo oxit bazơ với hầu hết kim loại
C. Oxi không có mùi và vị
D. Oxi cần thiết cho sự sống
Câu 2. Oxit nào sau đây làm chất hút ẩm?
A. Fe2O3
B. Al2O3
C. CuO
D. CaO
Câu 3. Dãy oxit nào có tất cả các oxit đều tác dụng được với nước ở nhiệt độ thường
A. SO3, CaO, CuO, Al2O3
B. SO3, K2O, BaO, N2O5
C. MgO, CO2, SiO2, PbO
D. SO2, Al2O3, HgO, Na2O
Câu 4. P có thể có hoá trị III hoặc V. Hợp chất có công thức P2O5 có tên gọi là:
A. Điphotpho oxit
C. Photpho pentaoxit
B. photpho oxit
D. Điphotpho pentaoxit
Câu 5. Có 4 lọ đựng riệng biệt: nước cất, dung dịch H2SO4, dung dịch NaOH, dung dịch NaCl. Bằng cách nào có thể nhận biết được mỗi chất trong các lọ?
A. Giấy quì tím
B. Giấy quì tím và đun cạn
C. Nhiệt phân và phenolphtalein
D. Dung dịch NaOH
Câu 6. Axit là những chất làm cho quỳ tím chuyển sang màu nào trong số các màu cho dưới đây?
A. Xanh
B. Đỏ
C. Tím
D. Không xác định được
Câu 7. Khi giảm nhiệt độ và tăng áp suất thì độ tan của chất khí trong nước thay đổi như thế nào?
A. Tăng
B. Giảm
C. Có thể tăng hoặc giảm
D. Không thay đổi
Câu 8. Trong 225 g nước có hoà tan 25g KCl. Nồng độ phần trăm của dung dịch là:
A. 10%
B. 11%
C. 12%
D. 13%
Câu 9. Hoà tan 16g SO3 vào nước để được 300ml dung dịch. Nồng độ của dung dịch H2SO4 thu được là:
A. 0,67M
B. 0,68M
C. 0,69M
D, 0,7M
Câu 10. Phản ứng nào dưới đây là phản ứng thế:
A. 2KClO3 ![]() \(\overset{t^{o} }{\rightarrow}\) 2KCl + O2
\(\overset{t^{o} }{\rightarrow}\) 2KCl + O2
B. P2O5 + 3H2O → 2H3PO4
C. FeO + 2HCl → FeCl2 + H2O
D. CuO + H2 ![]() \(\overset{t^{o} }{\rightarrow}\) Cu + H2O
\(\overset{t^{o} }{\rightarrow}\) Cu + H2O
Phần 2. Tự luận (6 điểm )
Câu 1. (2 điểm) Hòan thành các sơ đồ phản ứng sau:
Ca → CaO → Ca(OH)2 → CaCO3 → CO2
Câu 2. (1,5 điểm) Cho các chất có công thức hóa sau: H2SO4, Fe2(SO4)3, HClO, Na2HPO4. Hãy gọi tên và phân loại các chất trên.
Câu 3. (2,5 điểm) Người ta dẫn luồng khí H2 đi qua ống đựng 4,8 gam bột CuO được nung nóng trên ngọn lửa đèn cồn, cho đến khi toàn bộ lượng CuO màu đen chuyển thành Cu màu đỏ thì dừng lại.
a) Tính số gam Cu sinh ra?
b) Tính thể tích khí hiđro (đktc) vừa đủ dùng cho phản ứng trên?
c) Để có lượng H2 đó phải lấy bao nhiêu gam Fe cho tác dụng vừa đủ với bao nhiêu gam axít HCl.
Đáp án đề kiểm thi cuối kì 2 môn Hóa học lớp 8 - Đề số 3
Phần 1. Trắc nghiệm (4 điểm)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| A | D | B | D | B | B | A | B | A | D |
| Câu | Đáp án | Điểm |
|
Câu 1. (2 điểm) |
(1) Ca + O2 (2) CaO + H2O → 2Ca(OH)2 (3) Ca(OH)2 + CO2 → CaCO3 + H2O (4) CaCO3 |
0,5 0,5 0,5 0,5 |
|
Câu 2. (1,5 điểm) |
H2SO4: axit sunfuric Fe2(SO4)3: muối sắt (III) sunfat HClO: axit hipoclorơ Na2HPO4: natri hidrophotphat |
0,5 0,5 0,25 0,25 |
|
Câu 3. ( 2,5 điểm) |
a) CuO + H2 Theo phương trình ta có: Số mol của CuO = Số mol của Cu = 0,06 (mol) => Khối lượng của Cu sinh ra là: 0,06 x 64= 3,84g b) Số mol CuO = Số mol H2 = 0,06 (mol) => Thể tích của H2 = 0,06 22,4 =1,344 lít c) Fe + 2HCl → FeCl2 + H2 Theo phương trình ta có: Số mol Fe = Số mol H2 =>m Fe =0,06 56 = 3,36 gam |
0,25
0,5 0,75 0,25
0,75 |
Đề thi Hóa học kì 2 lớp 8 - Đề 4
Phần 1. Trắc nghiệm (4 điểm)
Câu 1. Trong các phản ứng hóa học sau, phương trình hóa học thuộc loại phản ứng thế là:
A. CaO + H2O → Ca(OH)2
B. Fe + H2SO4 → FeSO4 + H2
C. CaCO3 ![]() \(\overset{t^{\circ } }{\rightarrow}\) CaO + CO2
\(\overset{t^{\circ } }{\rightarrow}\) CaO + CO2
D. 5O2 + 4P ![]() \(\overset{t^{\circ } }{\rightarrow}\) 2P2O5
\(\overset{t^{\circ } }{\rightarrow}\) 2P2O5
Câu 2. Độ tan của chất khí trong nước sẽ tăng nếu:
A. Giảm nhiệt độ và giảm áp suất
B. Giảm nhiệt độ và tăng áp suất
C. Tăng nhiệt độ và giảm áp suất
D. Tăng nhiệt độ và tăng áp suất
Câu 3. Chất nào sau đây được dùng để điều chế oxi trong phòng thí nghiệm:
A. K2O và KMnO4
C. H2SO4 và H2O
B. KMnO4 và KClO3
D. KOH và KClO3
Câu 4. Các chất nào sau đây tan được trong nước:
A. NaCl, AgCl.
C. NaOH, Ba(OH)2.
B. HNO3, H2SiO3.
D. CuO, AlPO4.
Câu 5. Hòa tan 5 g muối ăn vào 45 gam nước. Nồng độ phần trăm của dung dịch thu được là:
A. 5%
B. 10%
C. 15%
D. 20%
Câu 6. Dãy các chất hoàn toàn là công thức hóa học của các oxit:
A. SO2, BaO, P2O5, ZnO, CuO
B. SO2, BaO, KClO3, P2O5, MgO
C. CaO, H2SO4, P2O5, MgO, CuO
D. SO2, CaO, KClO3, NaOH, SO3
Câu 7. Khí hidro tác dụng được với tất cả các chất của nhóm chất nào dưới đây?
A. CuO, FeO, O3
B. CuO, FeO, H2
C. CuO, Fe2O3, H2SO4
D. CuO, CO, HCl
Phần 2. Tự luận (6 điểm)
Câu 1. (1,5 điểm) Hoàn thành các phương trình hóa học sau:
a. K2O + H2O →
b. Na + H2O →
c. Cu + O2 →
d. CxHy + O2 →
Câu 2. (1 điểm) Hãy dự đoán hiện tượng xảy ra và giải thích hiện tượng trong mỗi trường hợp sau:
a) Khi quạt gió vào bếp củi vừa mới tắt
b) Khi quạt gió vào ngọn nến đang cháy
Câu 3. ( 2,5 điểm) Đốt cháy hoàn toàn 6,9 gam Natri thì cần V lít khí oxi đo ở (đktc).
a) Viết phương trình hóa học của phản ứng xảy ra
b) Tính thể tích của khí Oxi đã dùng
c) Toàn bộ sản phẩm đem hòa tan hết trong nước thì thu được 180g dung dịch A. Tính nồng độ phần trăm của dung dịch A.
Câu 4. (1 điểm) Cho 24 gam hỗn hợp oxit CuO và Fe2O3 tác dụng hoàn toàn với hidro có dư thu được 17,6 gam hỗn hợp hai kim loại. Tìm khối lượng nước tao thành.
Cho nguyên tử khối của các nguyên tố: Cu = 64, O=16, Cl = 35,5, Fe = 56, H = 1, Na = 23
Đáp án đề kiểm tra học kì 2 môn Hóa học 8 - Đề số 4
Phần 1. Trắc nghiệm (4 điểm)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| B | C | B | C | B | A | A |
Phần 2. Tự luận (6 điểm)
| Câu | Đáp án | Điểm |
|
Câu 1. (1,5 điểm) |
a. K2O + H2O → 2KOH b. Na + H2O → NaOH + H2 c. 2Cu + O2 d. CxHy + (x- y/2) O2 |
0,5 0,5 0,25 0,25 |
|
Câu 2. (1 điểm) |
a) Lửa sẽ bùng cháy, do khi quạt gió vào bếp củi thì lượng oxi tăng lên. Nến sẽ tắt do khi quạt gió vào ngọn nến đang cháy sẽ làm nhiệt độ hạ thấp đột ngột |
0,5
0,5 |
|
Câu 3. ( 2,5 điểm) |
a) PTHH: 4Na + O2 b) Theo phương trình (1)
=> c) PTHH: Na2O + H2O → 2NaOH (2) Theo phương trình (1)
Theo phương trình 2 nNaOH = 0,15.2 = 0,3 mol => mNaOH = 0,3.40 = 12 gam =>
|
0,25 0,25
0,5
0,25
0,5
0,75 |
|
Câu 4. (1 điểm) |
Câu 4. Đặt số mol H2O tạo thành là x mol Ta có số mol H2 phản ứng = số mol H2O = x mol Áp dụng ĐLBT: 24 + 2x = 17,6 + 18x x = 0,4 mol Khối lượng nước là: 0,4 x 18 = 7,2 gam |
0,5
0,5 |
Tài liệu vẫn còn, mời các bạn tải tài liệu về để xem đầy đủ nội dung bộ đề
VnDoc đã giới thiệu Bộ đề thi Hóa học kì 2 lớp 8 năm 2021 tới các bạn. Bộ đề thi Hóa học kì 2 gồm 10 đề thi, với nội dung cấu trúc, số lượng câu hỏi trắc nghiệm và tự luận ở mỗi đề thi khác nhau, đảm bảo phù hợp với nội dung chương trình.
Mời các tham khảo thêm một số tài liệu liên quan:
- 20 Bộ đề thi hóa 8 học kì 2 năm 2020 - 2021 Có đáp án
- Đề cương ôn tập học kì 2 môn Hóa học lớp 8 năm 2020 - 2021
- Các dạng bài tập Hóa 8 đầy đủ từ cơ bản đến nâng cao
Hy vọng bộ đề kiểm tra Hóa học kì 2 này sẽ giúp các em ôn luyện tốt, cũng như là tài liệu hữu ích dành cho thầy cô tham khảo trong quá trình ôn tập và ra đề cho các ban học sinh.
Ngoài Bộ đề thi Hóa học kì 2 lớp 8 năm 2021 trên, các em học sinh lớp 8 còn có thể tham khảo Trắc nghiệm Hóa học 8 và đề thi học kì 2 lớp 8 của các môn Toán lớp 8, môn Vật Lý lớp 8 và Tiếng Anh lớp 8 mà VnDoc.com đã sưu tầm và chọn lọc. Hy vọng với những tài liệu này, các em học sinh sẽ học tốt môn Hóa học lớp 8 hơn.
Ngoài ra, VnDoc.com đã thành lập group chia sẻ tài liệu học tập THCS miễn phí trên Facebook: Tài liệu học tập lớp 8. Mời các bạn học sinh tham gia nhóm, để có thể nhận được những tài liệu mới nhất.
 \(\begin{array}{l}
{n_{Zn}} = {n_{{H_2}SO{}_4}} = 0,3mol = > {m_{{H_2}SO{}_4}} = 0,3 \times 98 = 29,4g\\
C{\% _{{H_2}SO{}_4}} = \frac{{{m_{{H_2}SO{}_4}}}}{{{m_{dd{H_2}SO{}_4}}}} = \frac{{29,4}}{{150}} \times 100 = 19,6\%
\end{array}\)
\(\begin{array}{l}
{n_{Zn}} = {n_{{H_2}SO{}_4}} = 0,3mol = > {m_{{H_2}SO{}_4}} = 0,3 \times 98 = 29,4g\\
C{\% _{{H_2}SO{}_4}} = \frac{{{m_{{H_2}SO{}_4}}}}{{{m_{dd{H_2}SO{}_4}}}} = \frac{{29,4}}{{150}} \times 100 = 19,6\%
\end{array}\)


